La résection d’un sarcome osseux a pour objectif d’obtenir des marges adaptées, en privilégiant les chirurgies conservatrices, tout en s’efforçant de préserver la meilleure qualité de vie.1 La chirurgie doit être effectuée par une équipe spécialisée dans un centre de référence intégré au réseau NetSarc+, ce qui diminue le risque de récidive locale. La reprise chirurgicale à la suite d’un geste inadapté (biopsie ou exérèse) ne permet pas de replacer le patient dans des conditions optimales.
Grands principes de la chirurgie des sarcomes osseux
Spécificités des modalités de biopsie
La biopsie d’un sarcome osseux respecte les mêmes critères de qualité que celle des sarcomes des tissus mous, avec quelques spécificités. La biopsie percutanée a l’avantage d’une morbidité réduite, mais la biopsie chirurgicale garde toute sa place compte tenu des difficultés à poser un diagnostic précis sur un microprélèvement de tissu osseux. Pour les sarcomes rachidiens, les trajets transpédiculaires sont privilégiés, en veillant à respecter le pédicule le moins atteint par la tumeur, afin de faciliter la résection. Les biopsies à ciel ouvert ou les laminectomies réalisées en urgence (même en présence de signes neurologiques) doivent être évitées car elles compromettent les chances de réaliser une chirurgie adéquate.
Qualité des marges de résection d’un sarcome osseux
La qualité des marges de résection est traditionnellement évaluée par la mesure de l’épaisseur de tissu sain. Malgré les progrès de l’imagerie par résonance magnétique (IRM) et le développement de systèmes de navigation peropératoire, il n’est pas possible d’avoir une précision chirurgicale tridimensionnelle de l’ordre du millimètre. L’épaisseur de résection doit être surestimée par le chirurgien afin de limiter le risque d’effraction intratumorale. L’écart entre l’épaisseur de résection planifiée et la marge anatomopathologique minimale adéquate constitue un critère de qualité de la chirurgie. La marge adéquate varie selon la nature du tissu avoisinant, le type histologique de la tumeur et la réponse à la chimiothérapie.
L’utilisation de guides de coupe sur mesure ou d’un système de navigation scanographique peropératoire permet d’augmenter la précision des coupes osseuses et améliore le confort de l’opérateur.2 Un cartilage de croissance actif constitue une barrière anatomique efficace qui permet de diminuer l’épaisseur de la résection et augmente ainsi les possibilités de conservation épiphysaire. Une extension extra-osseuse importante complexifie l’obtention de marges saines.
Adaptations selon la localisation
Les modalités générales de la chirurgie des sarcomes osseux ne sont pas applicables indifféremment à toutes les localisations, ni à tous les types histologiques.
Sarcomes des membres
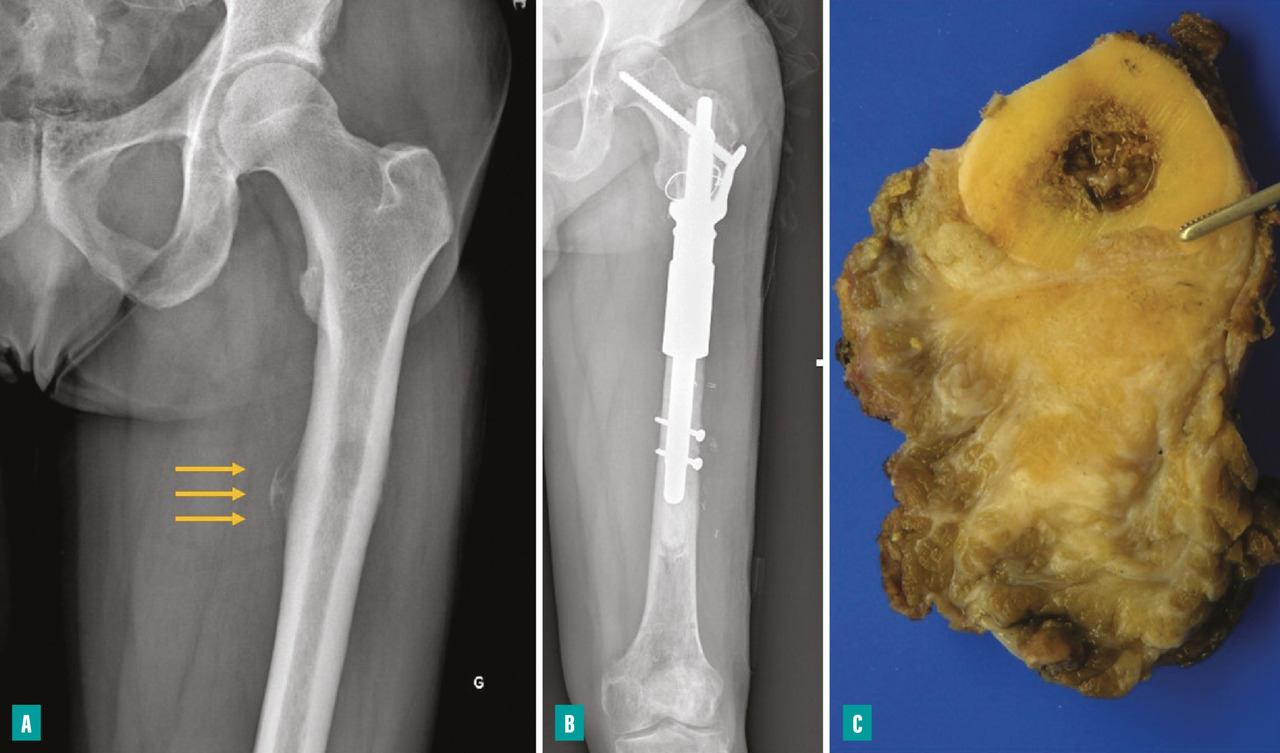
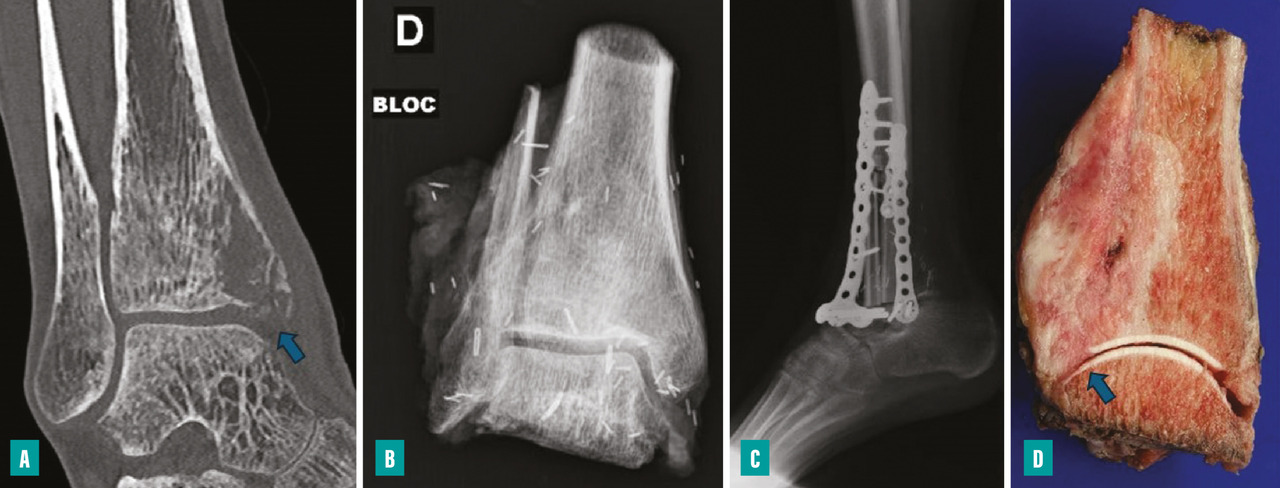
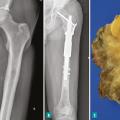
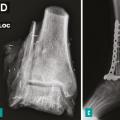
Pour les sarcomes des membres, la préservation de la fonction articulaire est le facteur déterminant. Dans la mesure du possible, les chirurgies avec préservation épiphysaire doivent être privilégiées (fig. 1). En cas d’atteinte épiphysaire, le choix de la technique opératoire dépend de la présence ou non d’un envahissement intra-articulaire, qui nécessite alors de recourir à une résection dite « extra-articulaire », techniquement plus exigeante (fig. 2). L’imagerie par résonance magnétique (IRM) a une place de choix pour identifier cette contamination articulaire.
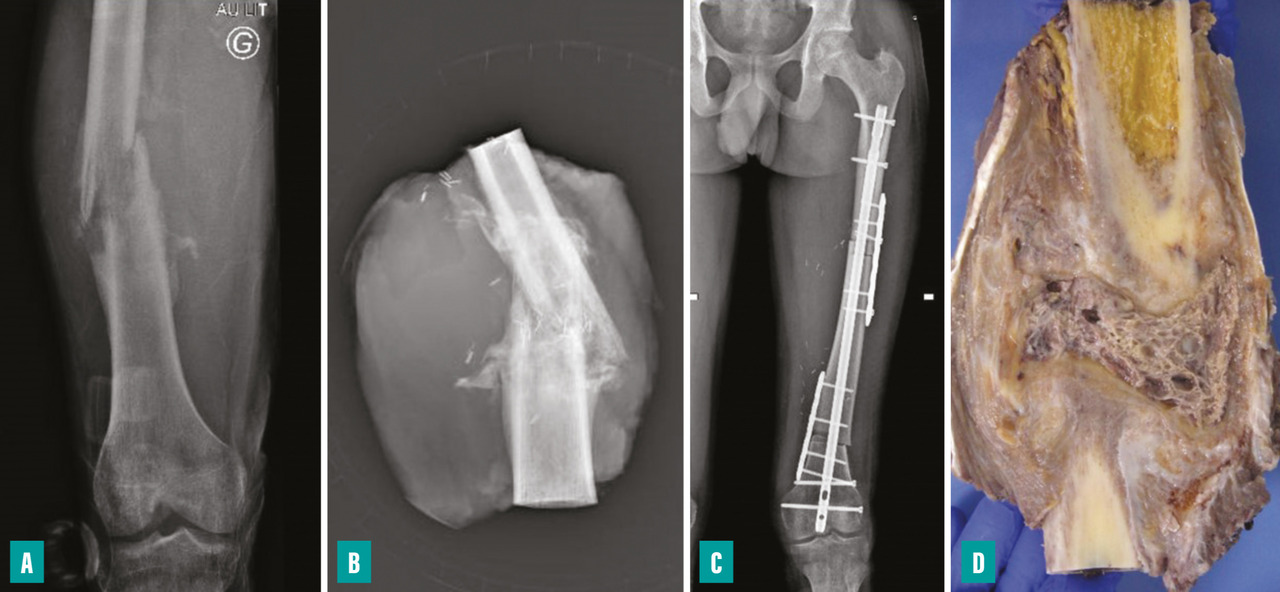
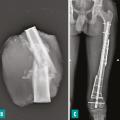
La survenue d’une fracture pathologique rend plus difficile l’obtention de marges saines du fait de la dissémination de l’hématome dans les tissus mous. Elle ne semble pas augmenter le risque de récidive locale – à la condition d’obtenir des marges saines – et ne constitue donc pas une indication d’amputation (fig. 3). Lorsqu’elle survient en cours de traitement, elle fait craindre une mauvaise réponse à la chimiothérapie, qui pourrait expliquer le moins bon pronostic de ces patients.3,4
Sarcomes du rachis
La résection d’un sarcome du rachis est une technique exigeante qui requiert généralement une prise en charge multidisciplinaire (thoracique, vasculaire, orthopédique). Les vertébrectomies totales en bloc sont préférentiellement réalisées par des voies d’abord combinées afin de sécuriser la qualité des marges et de limiter le risque de choc hémorragique.5,6
Les séquences opératoires peuvent être résumées en quatre étapes :
- libération postérieure par une voie verticale médiane standard (laminectomie des étages adjacents et préparation d’un passage pour la moelle, en fonction de l’extension tumorale dans l’arc postérieur) et fixation par la même voie postérieure ;
- libération antérieure (à ciel ouvert ou vidéo-assistée) ;
- vertébrectomie proprement dite (habituellement réalisée par la voie postérieure) ;
- reconstruction vertébrale antérieure par cage, plus ou moins ostéosynthèse lorsqu’elle est requise.
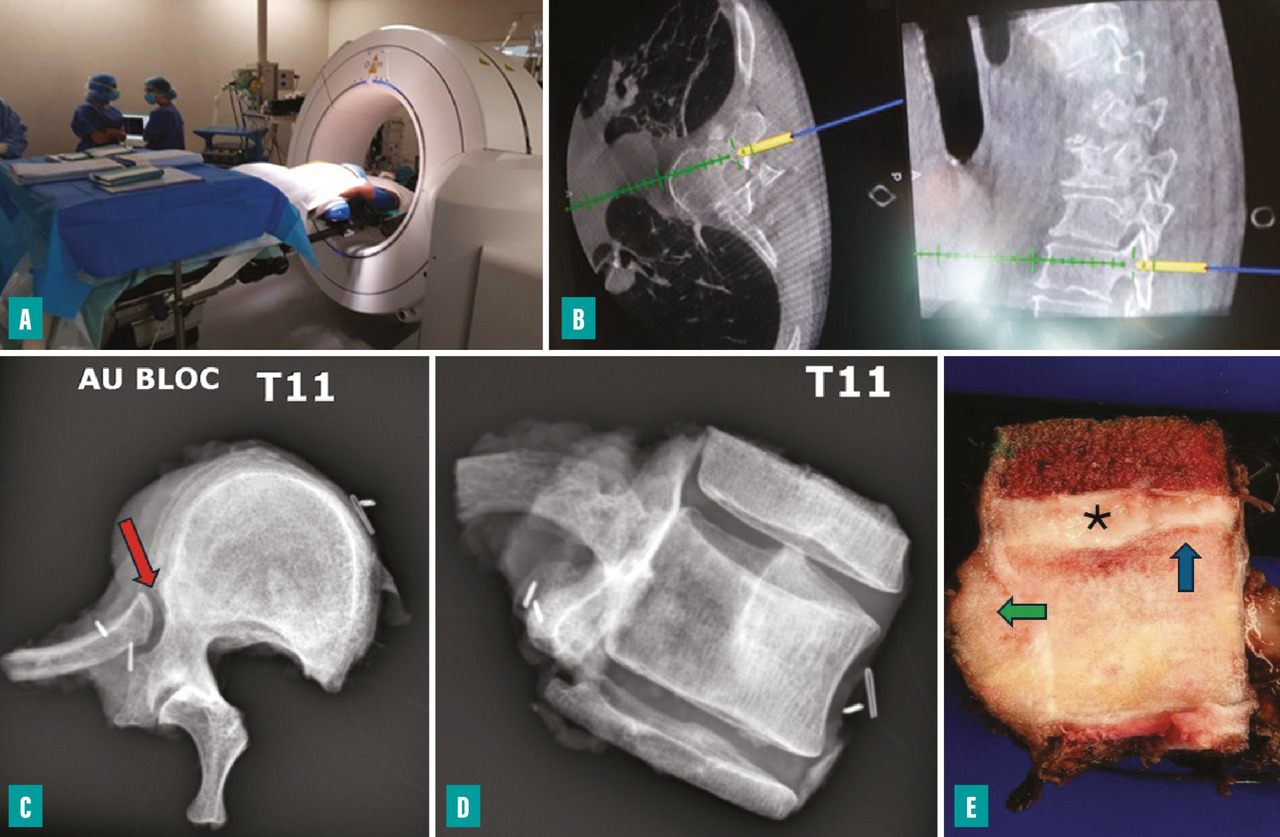
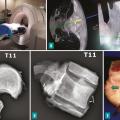
L’utilisation d’un système de navigation peropératoire (scanner peropératoire ou guides de coupe) permet de contrôler le trajet de l’ostéotomie (fig. 4). La libération de la moelle n’est possible que si au moins un des deux pédicules (voire une lame) est intact. Pour le rachis cervical, l’exposition lors de la libération antérieure est essentiellement limitée par les rapports avec les artères carotides externes et les artères vertébrales. Une interruption du flux artériel est parfois rendue nécessaire afin de limiter le saignement peropératoire (ligature de la carotide externe ou occlusion endovasculaire de la vertébrale).
Les difficultés techniques rencontrées au cours des sacrectomies (chordomes) dépendent essentiellement du niveau proximal de la résection, qui lui-même détermine le type d’ostéosynthèse pour la reconstruction.
Il s’agit d’une chirurgie particulièrement exposée aux complications (hémorragie, infection, pseudarthrose). Le développement des techniques de libération cœlioscopique antérieure dans la chirurgie des tumeurs du sacrum a permis de diminuer le volume de saignement, en offrant un meilleur contrôle des vaisseaux.7
La survenue d’une infection est un facteur de risque de morbidité (descellement de prothèse, amputation, prolongement de la durée du séjour hospitalier) et de mortalité (retard à la mise en route d’une chimiothérapie).8 La localisation (bassin, sacrum), la durée d’intervention, le volume de saignement, la reconstruction par prothèse et l’existence d’espaces morts sont des facteurs de risque d’infection.9 - 11
L’utilisation de voies d’abord combinées a pour intérêt de diminuer le risque de nécroses cutanées et musculaires.
Pour la chirurgie du sacrum, la contamination de la zone opératoire pourrait être favorisée par l’incontinence fécale (sacrectomies hautes) et la proximité de l’orifice anal. La réalisation d’une dérivation colique est parfois proposée afin de prévenir ce risque.
La chirurgie des sarcomes de la base du crâne ou du rachis cervical supérieur est rarement possible de façon large mais doit s’efforcer d’être la plus complète possible pour limiter le risque de récidive. Elle est associée à un taux élevé de complications postopératoires (infection, fuite de liquide céphalorachidien, méningite, paralysie des nerfs crâniens, dysphagie, régurgitation nasale, démontage de l’ostéosynthèse…), ce d’autant qu’une radiothérapie adjuvante est souvent jugée nécessaire.
Particularités chez l’enfant et l’adolescent
Chez l’enfant, la reconstruction doit prendre en compte la problématique du potentiel de croissance.12 Les prothèses de croissance semblent être associées à des taux de complications infectieuses et mécaniques plus élevés que les prothèses standard. Leur indication cible se situe entre 5 et 15 ans ; elles nécessitent d’être changées après la fin de la croissance. Pour les enfants plus jeunes, l’encombrement des prothèses n’est pas compatible avec les dimensions de l’os receveur. Pour les plus âgés, l’épiphysiodèse controlatérale permet de stopper la croissance, mais elle n’est proposée que si le potentiel de croissance reste limité (fin de puberté) ou pour des physes à faible activité (humérus distal, fémur proximal). L’allongement extemporané permet de mettre en place la reconstruction définitive mais est limité par l’élasticité des tissus (risque de paralysie et/ou de raideur articulaire).
Séquelles fonctionnelles et qualité de vie
Sarcomes des membres
Les chirurgies conservatrices des membres doivent être privilégiées pour préserver la qualité de vie des patients.13 Les endoprothèses massives sont malgré tout associées à un risque élevé de complications, avoisinant les 50 %,14 et nécessitent un suivi au long cours. Leur durée de vie est plus faible que celle des prothèses standard, en raison de problèmes mécaniques (fracture périprothétique, faillite des implants) ou infectieux. Le rôle du médecin traitant est primordial pour la détection de ces complications (douleurs, syndrome inflammatoire inexpliqué). Dans ce cas, le patient doit être réadressé directement au centre de référence NETSARC+. Chaque changement de prothèse s’accompagne d’une détérioration du résultat fonctionnel (douleurs, raideur) et augmente le risque d’infection ou d’amputation.
Sarcomes du rachis
La chirurgie des sarcomes rachidiens s’efforce de préserver au mieux les fonctions neurologiques. Pour les sacrectomies basses, la conservation d’au moins une racine S3 permet d’espérer la préservation complète des fonctions génitosphinctériennes. En cas de sacrifice bilatéral des racines S2, le patient doit supporter la perte définitive des fonctions sphinctériennes.7
Suivi des patients opérés d’un sarcome osseux
Les récidives locales après l’exérèse d’un sarcome osseux peuvent être très tardives et justifient un suivi prolongé par IRM.7 La chirurgie peut garder son intérêt lors de la survenue d’une récidive, à la condition d’un dépistage suffisamment précoce. Cela est particulièrement vrai pour les récidives tardives, témoignant d’une maladie lentement évolutive.
Les patients opérés d’un sarcome osseux restent définitivement exposés à un risque d’infection du matériel de reconstruction. Le médecin généraliste joue un rôle central dans la détection de ces complications infectieuses. Le risque d’infection par voie hématogène est élevé et justifie de surveiller attentivement les foyers infectieux potentiels. Quand elle est prise en charge suffisamment tôt, une infection d’endoprothèse peut, dans certains cas, être guérie par un lavage simple, sans devoir remplacer l’ensemble de la reconstruction. Une attention particulière doit être accordée au suivi des patients pédiatriques porteurs d’endoprothèse de croissance. Un relais en fin de croissance en milieu spécialisé d’orthopédie oncologique adulte est nécessaire pour limiter les perdus de vue et anticiper les complications mécaniques.
2. Sternheim A, Kashigar A, Daly M, et al. Cone-beam computed tomography-guided navigation in complex osteotomies improves accuracy at all competence levels: A study assessing accuracy and reproducibility of joint-sparing bone cuts. J Bone Joint Surg Am 2018;100(10):e67.
3. Andreou D, Bielack SS, Carrle D, et al. The influence of tumor – and treatment – related factors on the development of local recurrence in osteosarcoma after adequate surgery. An analysis of 1355 patients treated on neoadjuvant Cooperative Osteosarcoma Study Group protocols. Ann Oncol 2011;22(5):1228‑35.
4. Bramer JAM, Abudu AA, Grimer RJ, et al. Do pathological fractures influence survival and local recurrence rate in bony sarcomas? Eur J Cancer 2007;43(13):1944‑51.
5. Missenard G, Bouthors C, Fadel E, et al. Surgical strategies for primary malignant tumors of the thoracic and lumbar spine. Orthop Traumatol Surg Res 2020;106(1S):S53‑62.
6. Court C, Boulate D, Missenard G, et al. Video-assisted thoracoscopic en bloc vertebrectomy for spine tumors: Technique and outcomes in a series of 33 patients. J Bone Joint Surg Am 2021;103(12):1104‑14.
7. Court C, Briand S, Mir O, et al. Management of chordoma of the sacrum and mobile spine. Orthop Traumatol Surg Res 2022;108(1S):103169.
8. Anderson DJ, Kaye KS, Classen D, et al. Strategies to prevent surgical site infections in acute care hospitals. Infect Control Hosp Epidemiol 2008;29 Suppl 1:S51-61.
9. Jeys LM, Grimer RJ, Carter SR, et al. Periprosthetic infection in patients treated for an orthopaedic oncological condition. J Bone Joint Surg Am 2005;87(4):842‑9.
10. Korol E, Johnston K, Waser N, et al. A systematic review of risk factors associated with surgical site infections among surgical patients. PloS One 2013;8(12):e83743.
11. Beecher SM, OʼLeary DP, McLaughlin R, et al. The impact of surgical complications on cancer recurrence rates: A literature review. Oncol Res Treat 2018;41(7‑8):478‑82.
12. Kelly SP, Ramkumar DB, Crawford B, et al. Management of limb length discrepancy after bone sarcoma resection about the knee in the skeletally immature. J Pediatr Orthop B 2024;33(5):497-502.
13. Mason GE, Aung L, Gall S, et al. Quality of life following amputation or limb preservation in patients with lower extremity bone sarcoma. Front Oncol 2013;3:210.
14. Thornley P, Vicente M, MacDonald A, et al. Causes and frequencies of reoperations after endoprosthetic reconstructions for extremity tumor surgery: A systematic review. Clin Orthop 2019;477(4):894‑902.