La prise en charge des patients atteints d’asthme a pour finalité d’assurer un bon contrôle des symptômes et de prévenir la survenue d’exacerbations, afin d’obtenir une qualité de vie optimale tout en limitant les effets indésirables des traitements en « visant » la dose minimale efficace. La stratégie de contrôle de l’asthme repose ainsi sur des mesures pharmacologiques et non pharmacologiques qui doivent être adaptées à chaque patient.
Prise en charge pharmacologique
Les traitements médicamenteux ciblent les trois composantes de l’asthme : l’inflammation bronchique chronique, le remodelage des voies aériennes et l’hyperactivité bronchique. Deux classes thérapeutiques principales sont utilisées :
- les corticostéroïdes inhalés (CSI), qui ont un effet anti-inflammatoire les rendant essentiels dans la prise en charge de l’asthme ;
- les bronchodilatateurs, qui ciblent la bronchoconstriction par leur action sur le muscle lisse, via les récepteurs β2 pour les bronchodilatateurs de type β2 -mimétiques, ou par inhibition compétitive des récepteurs cholinergiques muscariniques (M3) pour les bronchodilatateurs de type anticholinergique dont l’usage est réservé à un stade plus tardif.
Le choix du traitement s’appuie sur les recommandations de la Société française de pneumologie parues en 20211 et sur les recommandations internationales de la GINA (Global Initiative for Asthma) plus récemment actualisées.2 L’adaptation du traitement se fait par étapes, avec une pression thérapeutique croissante en fonction du contrôle de la pathologie, avec le plus souvent un traitement de fond quotidien à base de corticostéroïdes inhalés associé à un traitement de secours (tableau 1).
Comment introduire le traitement ?
Pour l’instauration d’un traitement, il existe plusieurs options :
- le plus souvent, débuter par un traitement de palier 2, CSI à faible dose, suffisant pour obtenir un bon contrôle de l’asthme ;1
- commencer par un traitement de palier 3 si l’asthme apparaît d’emblée peu contrôlé2 ou dans les suites d’une d’exacerbation ;1
- débuter par un palier 4 d’emblée en cas d’asthme très mal contrôlé lors de la première consultation ou dans les suites d’une exacerbation.2
Évaluer le contrôle pour ajuster le traitement
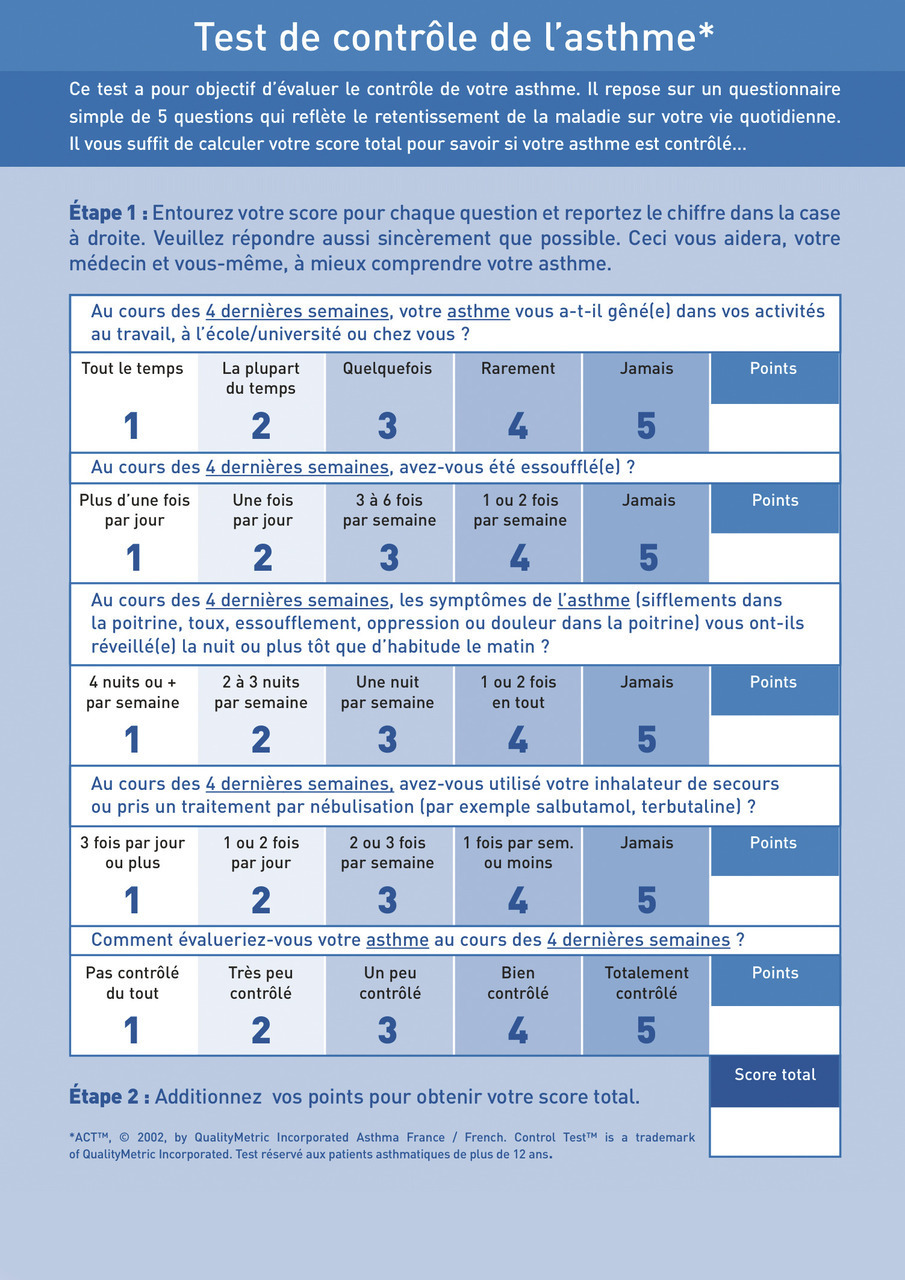
Une fois le traitement débuté, les ajustements de palier dépendent du contrôle de l’asthme, qui doit être évalué de manière objective. Pour cela, l’utilisation des questionnaires ACT (test de contrôle de l’asthme) avec cinq questions portant sur les symptômes des quatre dernières semaines (fig. 1) et ACQ (Asthma control questionnaire) avec six questions portant sur les symptômes des sept derniers jours (fig. 2) est recommandée. L’asthme est dit contrôlé si le score est supérieur à 20/25 pour l’ACT et supérieur à 1,5 pour l’ACQ. Le recours à ces outils est essentiel car la perception subjective du médecin est souvent incorrecte et différente de celle du patient.2,3 Les patients doivent être réévalués entre un et trois mois après l’introduction du traitement, puis tous les trois à douze mois selon l’évolution.
Les épreuves fonctionnelles respiratoires, plus particulièrement une spirométrie, doivent également être répétées entre trois à six mois après l’introduction du traitement, puis tous les un à deux ans au minimum. L’asthme est dit contrôlé s’il n’y a pas d’obstruction bronchique : volume expiratoire maximal par seconde/capacité vitale forcée (VEMS/CVF) > 0,7 et VEMS ≥ 80 %. Enfin, les exacerbations doivent être rares et idéalement absentes pour définir un bon contrôle.
En cas de contrôle insuffisant de l’asthme, des comorbidités (détaillées plus loin) influençant le contrôle de la maladie doivent être systématiquement recherchées et prises en charge avant d’envisager une thérapeutique alternative ou le passage à un palier supérieur :
- pour les patients non contrôlés sous CSI à dose faible, le palier supérieur comprend un traitement additionnel par bronchodilatateur de longue durée d’action, de type β2 -mimétique (LABA) ;1
- pour les patients non contrôlés sous CSI et traitement additionnel par β2 -mimétique, il convient d’augmenter la dose de CSI. La posologie des CSI conditionne l’augmentation de palier en cas de non-contrôle à partir du palier 3 (tableau 2) ;
- l’usage d’un autre traitement additionnel doit rester prudent. La place des antileucotriènes (qui bloquent les récepteurs aux leucotriènes, médiateurs pro-inflammatoires) diminue progressivement compte tenu d’une efficacité moindre comparativement aux bronchodilatateurs de longue durée d’action4 et du risque d’effets indésirables neuropsychiatriques (rêves anormaux, trouble de l’attention, désorientation, anxiété, dépression, idées suicidaires).5 L’ajout de théophylline ne s’envisage que si les autres thérapeutiques disponibles ne sont pas accessibles.
Asthme « difficile à traiter » et asthme sévère
L’asthme est dit « difficile à traiter » lorsqu’il est non contrôlé malgré un traitement de fond comportant un CSI à dose moyenne ou forte associé à un deuxième traitement comme des antileucotriènes ou des bronchodilatateurs de type β2 -mimétique ou des corticoïdes oraux, ou nécessitant ces traitements pour assurer un contrôle des symptômes. À ce stade, il est recommandé d’adresser le patient à un pneumologue afin que celui-ci réévalue le diagnostic d’asthme, recherche des facteurs modifiables non traités avant de conclure ou non au diagnostic d’asthme sévère.
Si l’asthme reste non contrôlé malgré la correction de l’ensemble des facteurs, on parle alors d’asthme sévère. Le pneumologue peut décider, dans ce cas, l’introduction d’autres thérapeutiques après avoir phénotypé l’asthme dont est atteint son patient (tiotropium, azithromycine, biothérapie).
L’ajout de tiotropium, bronchodilatateur de longue durée d’action de type anticholinergique (LAMA), est recommandé uniquement chez les asthmatiques sévères non contrôlés par une association CSI à forte dose et LABA.
Chez les patients ayant un asthme sévère, le traitement par un anticorps monoclonal ne peut être débuté qu’après échec d’un traitement de fond comprenant au minimum un CSI à forte dose et un LABA (de préférence ayant un court délai d’action, tel le formotérol) et toujours en association à ce traitement comportant CSI et LABA (selon les recommandations de la Haute Autorité de santé : https ://urls.fr/FwbaOx) [lire « Biothérapies dans l’asthme de l’adulte », page 753].
En revanche, en cas de pathologie bien contrôlée, une diminution de la pression thérapeutique et le passage à un palier inférieur peut se discuter. L’objectif est de viser la dose minimale efficace de CSI, étant donné leurs effets indésirables locaux (candidoses, dysphonie)6 mais aussi systémiques (notamment insuffisance surrénalienne).7
Stratégie de secours
La stratégie concernant le traitement de secours en cas de majoration des symptômes d’asthme (essoufflement, sensation d’oppression thoracique, épisodes de toux sèche invalidante, sensation d’oppression thoracique) diffère à ce jour selon les recommandations citées.
Selon les recommandations françaises,1 elle est soit centrée sur les bronchodilatateurs de courte durée d’action (BDCA) de type β2 -mimétique ou sur une association CSI-formotérol. Les recommandations de la GINA1,2 reprises dans les recommandations européennes8 préconisent le recours à un traitement de secours par une association CSI-formotérol en première intention.
Cette dernière stratégie, communément désignée sous le nom de « protocole SMART », repose sur l’usage d’une même association médicamenteuse à base de formotérol, en traitement de fond et en traitement de secours, en respectant toutefois la posologie maximale quotidienne autorisée pour chacune des molécules.
Place de la corticothérapie systémique
Les recommandations actuelles réservent l’usage de la corticothérapie orale à deux situations bien définies :
- en cure courte lors d’exacerbation ;
- en traitement prolongé dans les asthmes sévères non contrôlés, où la dose minimale efficace doit être recherchée, et après avoir évalué la possibilité d’ajout de thérapeutiques spécifiques avec la réalisation d’un bilan complet pour phénotyper l’asthme.1
La gestion de la corticothérapie orale est un enjeu majeur dans la prise en charge compte tenu de ses nombreux effets indésirables (notamment maladies cardiovasculaires, insuffisance surrénalienne, ostéoporose, pneumopathie, désordres psychiatriques, déséquilibre glycémique)9 et du sur-risque de mortalité, de morbidité et de séjour hospitalier.10 Ces risques apparaissent à partir d’une dose cumulée de 2,5 mg/kg/j ou 1 000 mg/an, voire 500 mg/an selon certaines études,11 ce qui correspond à des doses atteintes dès le deuxième ou troisième épisode d’exacerbations annuelles.
Mesures non pharmacologiques
À ces mesures pharmacologiques, d’autres thérapies non médicamenteuses doivent s’ajouter dans la prise en charge du patient atteint d’asthme.
Une éducation thérapeutique est indispensable. Elle peut se faire grâce à la remise d’un plan d’action asthme, à la participation à des écoles de l’asthme et en intégrant les pharmaciens. Le rôle de ces derniers dans le suivi des patients atteints d’asthme a été renforcé par la signature d’une convention publiée au Journal officiel en avril 2022 (arrêté du 31 mars 2022),12 qui leur permet de réaliser des entretiens pharmaceutiques, d’assurer une éducation thérapeutique et de suivre l’observance des traitements.
L’observance et la technique de prise du traitement inhalé sont des éléments clés à vérifier à chaque consultation. Il faut adapter le dispositif d’inhalateur à chaque patient, possiblement en s’aidant du Guide Zéphir de la SPLF (https ://splf.fr/videos-zephir), et faire avec le patient le choix entre les aérosols-doseurs (nécessitant une bonne synchronisation déclenchement de l’aérosol/’inspiration du patient), et les dispositifs à base de poudre (qui requièrent une bonne capacité inspiratoire).13
Une enquête allergologique est systématique chez tout patient atteint d’asthme en raison de l’impact des allergènes sur le contrôle des symptômes d’asthme ; elle repose sur un interrogatoire et des tests cutanés aux pneumallergènes pouvant être complétés par des dosages d’IgE spécifiques. La prise en charge consiste en l’éviction des allergènes respiratoires et le recours parfois à une immunothérapie, notamment pour les patients allergiques aux acariens et présentant une rhinite persistante.1
La prise en charge des comorbidités fréquemment rencontrées telles qu’un reflux gastro-œsophagien, une obésité, un syndrome d’apnées du sommeil ou des symptômes ORL est indispensable, car elles favorisent un mauvais contrôle de la pathologie.
Un syndrome d’hyperventilation est à rechercher à l’aide du questionnaire de Nijmegen (fig. 3). Il s’agit à la fois d’un diagnostic différentiel et d’une comorbidité de l’asthme.2,14
Il ne faut pas méconnaître la prise en charge psychologique, qui a également un impact sur le contrôle de la maladie.15
L’exposition à des agents irritants respiratoires, domestiques, professionnels et extérieurs doit être recherchée et limitée au minimum. Les patients fumeurs doivent être encouragés au sevrage. La recherche d’un asthme professionnel est particulièrement nécessaire pour les boulangers-pâtissiers, professionnels de santé, peintres, travailleurs du bois, agents de nettoyage. Enfin, il s’agit d’éliminer une pathologie exacerbée par l’aspirine, dont la prise en charge repose sur des mesures d’éviction.
La pratique d’une activité physique régulière doit être encouragée. Un séjour en centre de réhabilitation respiratoire est une alternative possible afin de lutter contre un déconditionnement musculaire.16
Enfin, il faut vérifier la mise à jour des vaccinations antigrippale, contre le Covid- 19 et antipneumococcique, recommandées chez tous les patients atteints d’asthme.
Déployer les moyens d’utiliser une dose minimale efficace
L’asthme est une maladie inflammatoire chronique dont la pierre angulaire du traitement repose sur la corticothérapie inhalée, à la dose minimale efficace compte tenu des effets indésirables potentiels, cela étant permis grâce aux contrôles des facteurs aggravants possibles et à une éducation thérapeutique.
2. Global Initiative for Asthma (GINA). Global strategy for asthma management and prevention 2023 update. https://urls.fr/FiVLpz
3. Taylor DR, Bateman ED, Boulet LP, et al. A new perspective on concepts of asthma severity and control. Eur Respir J 2008;32(3):545‑54.
4. Ducharme FM, Lasserson TJ, Cates CJ. Addition to inhaled corticosteroids of long‐acting beta2‐agonists versus anti‐leukotrienes for chronic asthma. Cochrane Database Syst Rev 2011. https://urls.fr/BP8XTv5. ANSM. RCP Montelukast. Notice patient 2022. https://urls.fr/ZXtg87
6. Rochat TS, Janssens JP. Effets secondaires systémiques et oropharyngés des corticostéroïdes inhalés. Rev Med Suisse 2012;363(41):2219‑23.
7. Kachroo P, Stewart ID, Kelly RS, et al. Metabolomic profiling reveals extensive adrenal suppression due to inhaled corticosteroid therapy in asthma. Nat Med 2022;28(4):814‑22.
8. Papi A, Ferreira DS, Agache I, et al. European Respiratory Society short guidelines for the use of as-needed ICS/formoterol in mild asthma. Eur Respir J 2023;62(4):2300047.
9. Sweeney J, Patterson CC, Menzies-Gow A, et al. Comorbidity in severe asthma requiring systemic corticosteroid therapy: Cross-sectional data from the optimum patient care research database and the British thoracic difficult asthma registry. Thorax 2016;71(4):339‑46.
10. Volmer T, Effenberger T, Trautner C, et al. Consequences of long-term oral corticosteroid therapy and its side-effects in severe asthma in adults: A focused review of the impact data in the literature. Eur Respir J 2018;52(4):1800703.
11. Skov IR, Madsen H, Henriksen DP, et al. Low-dose oral corticosteroids in asthma associates with increased morbidity and mortality. Eur Respir J 2022;60(3):2103054.
12. Légifrance. Journal officiel du 10 avril 2022. Arrêté du 31 mars 2022 portant approbation de la Convention nationale organisant les rapports entre les pharmaciens titulaires d’officine et l’assurance maladie. https://urls.fr/fEgBJQ
13. Guide Zéphir : guide des thérapeutiques inhalées dans l’asthme et la BPCO chez l’adulte. https://guidezephir.fr
14. Selleron B, Chenivesse C. Le syndrome d’hyperventilation, définition, diagnostic et thérapeutique. Rev Mal Respir 2023;40(6):499‑505.
15. Rolland-Debord C, Goriounov I, Pitron V. The psychological burden of asthma. Rev Mal Respir 2021;38(7):721‑32.
16. Feng Z, Wang J, Xie Y, et al. Effects of exercise-based pulmonary rehabilitation on adults with asthma: A systematic review and meta-analysis. Respir Res 2021;22(1):33.