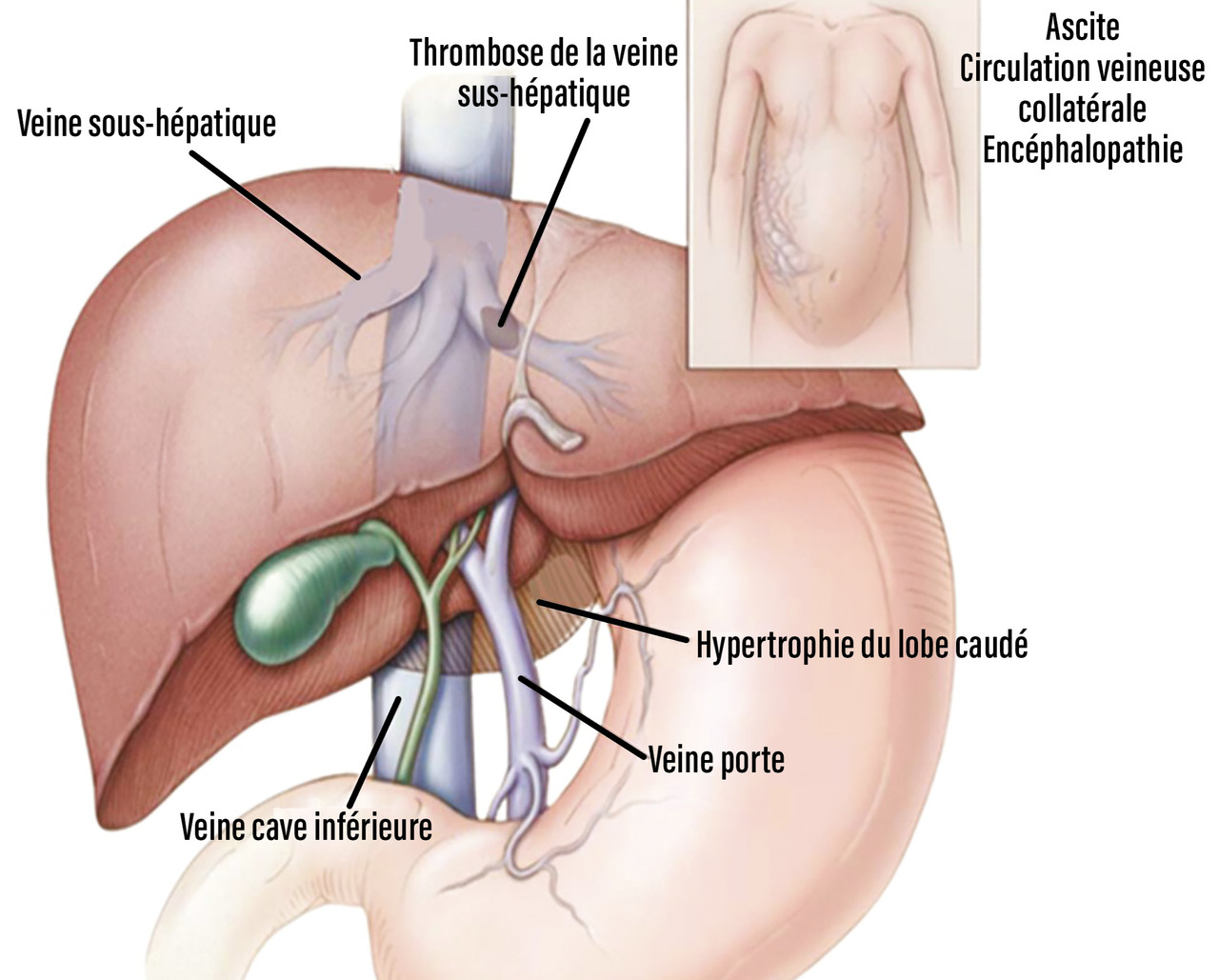
Le syndrome de Budd-Chiari (SBC) est une affection rare caractérisée par une obstruction du drainage veineux hépatique, commençant au niveau des veinules hépatiques jusqu’à la partie terminale de la veine cave inférieure. Il peut se manifester par un tableau d’hépatite fulminante, notamment en cas d’obstruction complète des trois veines hépatiques (fig. 1). La prise en charge thérapeutique repose sur des mesures médicales et une stratégie séquentielle de rétablissement du flux veineux hépatique, de préférence dans un centre expert en maladies vasculaires du foie. Le traitement du SBC a évolué au fil des ans, et le shunt porto systémique intrahépatique par voie jugulaire (TIPS) a modifié de manière significative la prise en charge et le pronostic de ces patients, en permettant d’éviter la transplantation hépatique. La surveillance du patient atteint de SBC par une équipe multidisciplinaire est indispensable tout au long de la vie en raison des risques de complications de la maladie causale ou de la maladie hépatique et du risque de transformation maligne. Les projets de vie des patients doivent être anticipés et le rôle du médecin traitant est crucial dans la coordination des soins et la poursuite des traitements.
Trois conséquences physiopathologiques principales
Le SBC est défini comme un obstacle au niveau du retour veineux hépatique, pouvant être localisé entre les veinules hépatiques jusqu’à l’entrée de la veine cave inférieure (VCI) dans l’oreillette droite.1 C’est une maladie rare, avec une incidence annuelle moyenne d’un cas pour un million d’habitants. Il touche principalement les jeunes adultes, avec une prédominance féminine et un âge médian au diagnostic entre 35 et 40 ans.2
On en distingue deux formes :
- le SBC primaire, qui correspond à une thrombose ou à une sténose, en l’absence de compression par des lésions extrinsèques (kystes, tumeurs, parasites…) ;
- le SBC secondaire, qui est dû à la compression extrinsèque d’une ou plusieurs veines par une tumeur, un abcès, un kyste…
Les obstructions liées à des maladies cardiaques, péricardiques ou celles qui affectent spécifiquement les capillaires sinusoïdes du foie (syndrome d’obstruction sinusoïdale), sont exclues de cette définition.
L’obstruction veineuse hépatique a trois principales conséquences physiopathologiques :
- premièrement, un syndrome « phlébitique », qui se manifeste par de la fièvre, des douleurs abdominales et un syndrome inflammatoire dû à l’obstruction veineuse ;
- deuxièmement, l’augmentation de la pression au niveau des capillaires sinusoïdes hépatiques, qui entraîne une augmentation du volume du foie et une filtration accrue du liquide interstitiel, ce qui mène à une ascite rapide et massive, pouvant causer une hypovolémie et une insuffisance rénale aiguë. Cette pression élevée se transmet à la veine porte, provoquant une hypertension portale. Elle favorise aussi le développement de circulations veineuses collatérales qui réduisent la pression sinusoïdale et peuvent prévenir les manifestations cliniques comme l’ascite, les douleurs abdominales ou l’insuffisance hépatique sévère ;
- troisièmement, la diminution de la perfusion hépatique, qui peut entraîner une hypoxie transitoire, provoquant la nécrose des hépatocytes centrolobulaires. L’insuffisance hépatique qui en résulte est rarement fulminante grâce à des mécanismes compensatoires, comme la formation de circulations collatérales et l’hypertrophie des territoires mieux drainés, notamment le segment I.
Enfin, après l’obstruction, une fibrose centrolobulaire et une régénération nodulaire peuvent se développer, modifiant la structure hépatique et conduisant à des lésions telles que la cirrhose ou l’hyperplasie nodulaire régénérative qui peuvent se développer dans les mois qui suivent l’obstruction.3
Causes du SBC primaire
Un bilan étiologique à la recherche d’un état prothrombotique doit être réalisé en cas de SBC. Des facteurs prothrombotiques étaient, en effet, présents chez 84 % des patients atteints de SBC dans une vaste étude multicentrique européenne.4
Les causes principales à rechercher sont détaillées dans le tableau 1. Chez au moins un tiers des patients, plusieurs facteurs prothrombotiques sont identifiés.
Une des causes les plus fréquentes est la néoplasie myéloproliférative (NMP), qui entraîne une hyperplasie d’une ou plusieurs lignées sanguines et un risque de thromboses. Une NMP est retrouvée chez 30 à 40 % des patients atteints de SBC.
La mutation JAK2 V617F, présente chez 80 à 90 % des patients atteints de NMP et 41 % des SBC, doit être systématiquement recherchée 5. En son absence, il faut rechercher les mutations du gène codant pour la calréticuline (CALR) présentes chez 30 % des patients avec NMP-JAK2 négatifs ainsi que la mutation de l’exon 12 de JAK2 ou du gène codant le récepteur de la thrombopoïétine (myeloproliferative leukemia protein [MPL]).6 Si ces mutations sont négatives, il faut envisager, en accord avec un hématologue spécialiste, un séquençage de nouvelle génération (NGS) et une biopsie ostéomédullaire. Dans tous les cas, l’avis d’un hématologue expert est nécessaire.
Les facteurs prothrombotiques héréditaires associés au SBC qui doivent être recherchés incluent la mutation G20210A du gène de la prothrombine, la mutation du facteur V Leiden, qui est deux fois plus fréquente chez les patients atteints de SBC que dans la population générale, la mutation du facteur II, ainsi que les déficits héréditaires en protéines C, S et antithrombine. Parmi les facteurs prothrombotiques acquis, il faut rechercher un syndrome des anticorps antiphospholipides (SAPL), une hémoglobinurie paroxystique nocturne, la maladie de Behçet, la maladie cœliaque ou des facteurs hormonaux.7
La combinaison de plusieurs facteurs de risque génétiques ou acquis est observée chez 26 à 46 % des patients, ce qui justifie un bilan exhaustif même en présence d’un facteur favorisant identifié.4
Modalités diagnostiques et diagnostics différentiels
La présentation clinique du SBC est extrêmement variable, allant de formes asymptomatiques à des cas d’hépatite fulminante (moins de 1 %).
Situations qui doivent alerter
Ce diagnostic doit être envisagé dans les situations suivantes :
- lorsqu’une ascite, une augmentation du volume du foie et des douleurs abdominales hautes apparaissent simultanément (circonstance la plus fréquente) ;
- chez un patient présentant une maladie hépatique chronique avec une ascite réfractaire (surtout si elle est riche en protides) malgré des anomalies modérées des tests d’insuffisance hépatique ;
- lorsqu’une maladie hépatique apparaît chez un patient connu pour avoir une thrombophilie ;
- en cas d’hépatite fulminante avec augmentation du volume du foie et ascite ;
- lorsque la cause d’une hépatopathie chronique reste inexpliquée après les recherches habituelles.
Imagerie caractéristique
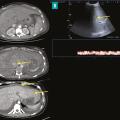
Dans presque tous les cas, les méthodes d’imagerie non invasives révèlent une obstruction des voies de drainage veineux hépatique. L’obstruction est confirmée par un flux sanguin stagnant ou inversé, la présence de matériel solide dans la veine, une obstruction avec dilatation en amont ou une transformation des veines en un cordon fibreux sans flux (fig. 2). Des signes indirects d’obstruction tels qu’une hépatomégalie congestive, des collatérales veineuses interhépatiques, une atrophie des segments atteints et une hypertrophie des segments non atteints ainsi que des signes d’hypertension portale peuvent également être observés.2 L’échographie abdominale couplée à un Doppler reste la méthode de référence pour le diagnostic, avec une sensibilité supérieure à 75 %, à condition que l’opérateur soit expérimenté et informé de cette hypothèse diagnostique.3 Les méthodes d’imagerie en coupes avec injection de produit de contraste (tomodensitométrie et imagerie par résonance magnétique) sont utiles pour caractériser la circulation collatérale inter- sus-hépatique, la veine cave inférieure, le tronc porte et les nodules, et pour rechercher des signes de SBC secondaire. Ces techniques peuvent révéler des images en toile d’araignée remplaçant l’aspect normal des veines hépatiques près de l’ostium, des images hyperdenses aux emplacements des veines hépatiques et des troubles de la perfusion hépatique (aspect en « mosaïque » dû à la congestion et à la dilatation sinusoïdale). Un rehaussement du segment I du foie est également visible lors de l’acquisition précoce après injection de produit de contraste, qui permet aussi la détection de nodules hépatiques.8
Place de la biopsie et de l’élastométrie hépatique
La biopsie hépatique peut être utile dans les rares cas de SBC des petites veines hépatiques où les veines hépatiques sont macroscopiquement perméables. Les caractéristiques histologiques du SBC incluent une nécrose hépatique, une dilatation sinusoïdale et une fibrose périsinusoïdale, surtout dans les zones centrolobulaires.2
L’élastométrie hépatique reflète principalement la congestion hépatique, ce qui limite son utilisation pour évaluer le degré de fibrose hépatique. Cependant, elle peut être utile pour apprécier l’évolution de cette congestion après un traitement efficace sur le drainage veineux.9
Les diagnostics différentiels incluent le syndrome d’obstruction sinusoïdale, l’insuffisance cardiaque, la cirrhose décompensée et l’infiltration tumorale du foie.
Prise en charge concertée avec un centre expert
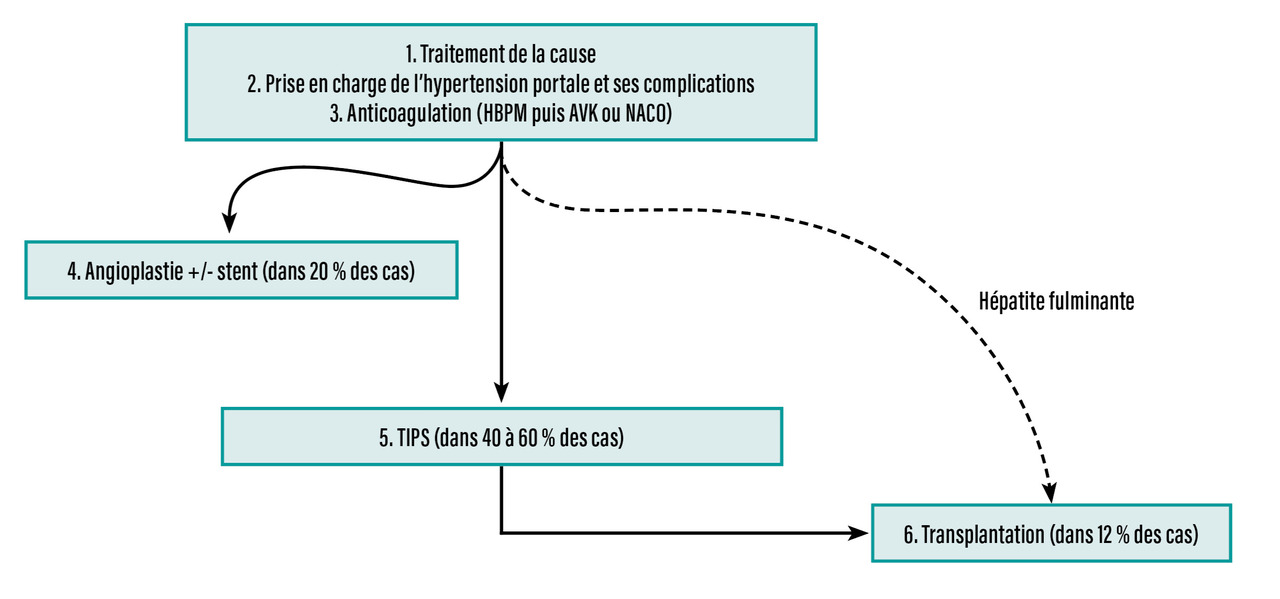
La prise en charge repose sur le traitement de la cause, une prévention des thromboses veineuses, le contrôle des manifestations de l’hypertension portale et le rétablissement du drainage veineux hépatique à basse pression.
La prise en charge des patients atteints de SBC doit toujours être discutée en concertation, de préférence avec un centre expert dans la prise en charge des maladies vasculaires du foie qui dispose d’un plateau de radiologie interventionnelle et d’une unité de transplantation hépatique. La liste et les coordonnées des centres experts sont disponibles sur le site de Filfoie (Filière de santé maladies rares du foie de l’adulte et de l’enfant) : https ://www.filfoie.com/ou-consulter/carte-interactive/ ?fwp_rseau_centre=mvf.
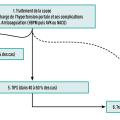
Une stratégie de traitement progressive, étape par étape, du moins invasif au plus invasif, est la règle (fig. 3). Cette approche a permis d’améliorer considérablement le pronostic des patients, avec une survie globale à cinq ans supérieure à 80 %.10
Rechercher, traiter la cause et débuter l’anticoagulation
Il est crucial d’identifier la situation de thrombophilie. Diagnostiquer et traiter une NMP, une hémoglobinurie paroxystique nocturne (HPN) ou une maladie de Behçet par des traitements spécifiques permet d’améliorer la survie sans complications et de diminuer le recours à des traitements plus invasifs, comme cela a été montré dans des analyses de cohorte rétrospective.11,12
L’anticoagulation doit être initiée dès le diagnostic du SBC, même en l’absence d’état prothrombotique identifié, l’objectif étant de prévenir la progression de la thrombose.
En raison du risque élevé de thrombocytopénie induite par l’héparine, principalement observé avec l’héparine non fractionnée, l’héparine de bas poids moléculaire (HBPM) est recommandée en première intention, suivie par les antagonistes de la vitamine K (AVK) pour maintenir un international normalized ratio (INR) entre 2 et 3, une fois la maladie stabilisée. Les anticoagulants oraux directs (AOD) semblent également sûrs et efficaces, bien que l’expérience soit limitée. Une anti-coagulation au long cours est nécessaire de principe pour tous les patients atteints de SBC.
En ce qui concerne la prise en charge des complications de l’hypertension portale, telles que l’ascite, les varices gastro-œsophagiennes, l’insuffisance rénale aiguë et l’encéphalopathie hépatique, elle est superposable à celle recommandée chez les patients atteints de cirrhose.13
Améliorer le flux permet de corriger l’hypertension portale, de réduire l’ischémie hépatique et ainsi de diminuer la sévérité de l’insuffisance hépatique.
Rétablir le drainage veineux hépatique
Il existe trois moyens de rétablir le drainage veineux hépatique : la reperméabilisation des voies de drainage obstruées, la dérivation portosystémique et la transplantation hépatique.
Reperméabilisation des voies de drainage obstruées
La reperméabilisation peut avoir lieu sous anticoagulants seuls, et dans ce cas il n’y a pas d’autre intervention à programmer.
Dans des cas très sélectionnés de thrombose récente, une thrombolyse locale après cathétérisme de la veine hépatique thrombosée peut aider à restaurer l’écoulement veineux. Toutefois, le rapport bénéfice/risque de cette approche est peu connu, et des complications hémorragiques potentiellement fatales peuvent survenir. Par conséquent, la thrombolyse doit être discutée et réalisée uniquement dans des centres tertiaires.
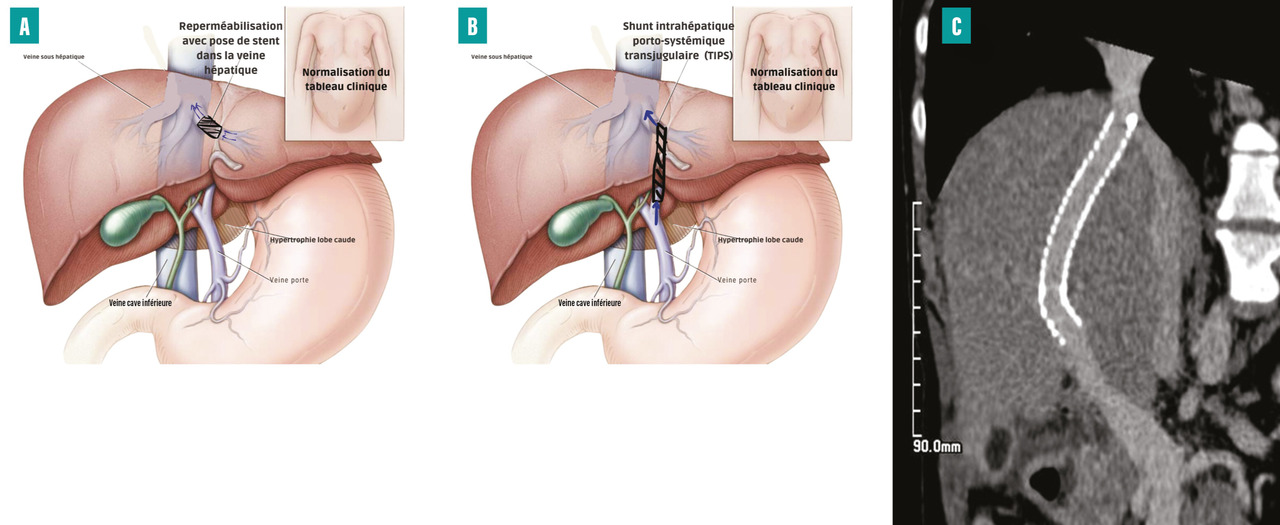
L’angioplastie, parfois couplée à la thrombolyse, peut être proposée en l’absence de recanalisation veineuse spontanée ou après un traitement anticoagulant. En cas de sténose courte d’une veine hépatique (environ 15 % des patients), une angioplastie transluminale percutanée de la sténose doit être systématiquement réalisée, car cette procédure est efficace et présente une faible morbidité. Une étude randomisée contrôlée a montré la supériorité de la pose d’un stent couplée à l’angioplastie par rapport à l’angioplastie seule dans la prise en charge des sténoses courtes(figure 4A).14
Dérivations portosystémiques
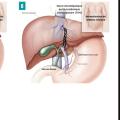
À l’heure actuelle, le shunt intrahépatique portosystémique par voie jugulaire (transjugular intrahepatic portosystemic shunt [TIPS]) est le traitement de choix pour réaliser une dérivation portosystémique. Le TIPS est une procédure interventionnelle radiologique qui consiste en la création d’une voie de dérivation entre une branche de la veine porte et une veine hépatique (ou son trajet supposé quand elle est totalement obstruée) afin de réduire la pression portale. Cette dérivation est réalisée en insérant un stent expansible au travers du parenchyme hépatique (fig. 4B et C). Son efficacité est proche de 90 %, et une étude multicentrique a montré une survie sans transplantation de 88 % à un an et de 78 % à cinq ans. La morbidité per- et postopératoire est faible, et la recanalisation en cas de sténose ou thrombose est accessible.15 Les complications précoces post-TIPS incluent les hémorragies (d’où l’importance d’une gestion périopératoire adaptée du traitement anticoagulant), les thromboses, l’insuffisance cardiaque et l’encéphalopathie hépatique. Cette dernière est la principale complication tardive, présente dans 6 à 20 % des cas, mais généralement transitoire. Elle nécessite un traitement adapté utilisant le lactulose et/ou la rifaximine.
Transplantation hépatique
La transplantation hépatique est nécessaire pour environ 10 % des patients atteints de SBC : pour ceux en échec des traitements précédents, en cas de présentation fulminante ou d’évolution rapidement défavorable malgré le traitement anticoagulant ou en cas de carcinome hépatocellulaire associé. Le TIPS peut parfois servir de traitement d’attente à la transplantation hépatique, notamment en cas d’insuffisance hépatocellulaire, et ne compromet pas les résultats de la transplantation.16
La survie globale après transplantation est de 77 % à cinq ans et de 68 % à dix ans.10 Une autre étude récente suggère que la présence ou l’absence d’un syndrome myéloprolifératif au moment du diagnostic n’affecte pas le pronostic vital à dix ans après transplantation. Cependant, la récidive de la maladie initiale après transplantation justifie la poursuite du traitement de la maladie causale et une anticoagulation curative à vie, qui peut être discutée si l’état prothrombotique est corrigé par la transplantation.
Place du médecin traitant
Le médecin traitant joue un rôle essentiel dans la coordination des soins et le suivi des patients atteints de SBC tout en veillant à ce que le traitement anticoagulant soit correctement suivi et équilibré au long cours. Ces patients doivent consulter plusieurs spécialistes tels que les internistes, hématologues et hépatologues, au moins une fois par an, et ils doivent réaliser régulièrement des examens d’imagerie et des bilans biologiques. Le médecin traitant assure la cohérence des soins dans cette prise en charge complexe. En parallèle, il accompagne les patients dans leur vie quotidienne. Par exemple, il peut être sollicité pour la délivrance de certificats médicaux adaptés à des besoins spécifiques, comme l’aménagement d’un tiers-temps pour les étudiants, la constitution de dossiers auprès de la maison départementale des personnes handicapées (MDPH) ou la reconnaissance de la maladie en affection de longue durée (ALD), la rédaction du protocole de soins en formulant une demande d’ALD « hors liste » si nécessaire (fig. 5).
Même lorsque l’état clinique du patient s’améliore, il est conseillé de maintenir un suivi spécialisé à vie, qui peut inclure des hospitalisations occasionnelles pouvant interférer parfois avec la scolarité ou la carrière professionnelle des patients.
La gestion de la grossesse chez les femmes atteintes du SBC représente un autre aspect important. La grossesse et le post-partum sont considérés à risque en raison du traitement anticoagulant et de l’hypertension portale ; le médecin traitant peut jouer un rôle clé en travaillant en collaboration avec les hépatologues, obstétriciens et hématologues du centre expert référent. L’utilisation des héparines de bas poids moléculaire est indispensable. Certaines patientes présentant une hypertension portale et des varices œsophagiennes peuvent également bénéficier d’un traitement par bêtabloquant pendant la grossesse. Afin d’anticiper cette prise en charge, une consultation préconceptionnelle doit être proposée aux patientes ayant un projet de grossesse.
Il est également utile d’informer, dès l’annonce du diagnostic, de l’existence d’associations de patients telles que l’Association des malades des vaisseaux du foie (AMVF : https ://www.amvf.asso.fr) [Lire « Vivre avec une maladie des vaisseaux du foie » dans La Revue du Praticien de janvier 2024]. Ces associations peuvent offrir un soutien précieux, contribuant à réduire l’isolement des patients et à accompagner les malades ainsi que leur famille.
Surveillance et devenir des patients
Le rythme de surveillance des patients atteints d’un SBC après stabilisation n’est pas clairement défini. Cependant, comme dans la cirrhose, une imagerie hépatique tous les six mois est recommandée pour surveiller l’apparition d’un carcinome hépatocellulaire. Les patients peuvent présenter des nodules hépatiques (environ 60 % des cas), souvent multiples, mesurant généralement moins de 4 cm, hypervasculaires sans sémiologie spécifique à l’imagerie. La plupart des nodules sont bénins, mais des adénomes hépatocellulaires ou des carcinomes hépatocellulaires (CHC) peuvent également apparaître. L’incidence cumulée à cinq ans du CHC est ainsi de 4 %.3,8,13
Le pronostic de la maladie s’est considérablement amélioré au cours des dernières années grâce à une meilleure prise en charge thérapeutique et à un diagnostic plus précoce. Dans une cohorte multicentrique prospective européenne, la survie à cinq ans était ainsi proche de 85 %.15
Certains scores pronostiques, comme les scores de Child-Pugh ou le score MELD, ou des scores plus spécifiques comme ceux de Clichy, de Rotterdam ou le score BCS-TIPS (Budd-Chiari syndrome transjugular intrahepatic portosystemic shunt), ont été proposés (tableau 2).17 Cependant, la prédiction individuelle du pronostic reste difficile, et ces scores ne peuvent pas être utilisés pour une prise en charge personnalisée.
L’évolution de la maladie causale (SMP, HPN, maladie de Behçet, etc.) peut également influencer le pronostic du SBC. Il est essentiel que les patients soient suivis régulièrement par un hématologue ou un référent spécialiste de la maladie causale, afin d’optimiser la prise en charge et d’améliorer leur pronostic.
Suivi au long cours essentiel
Il est essentiel que les patients atteints de SBC continuent à vie leur suivi du risque de récidive de thrombose, d’aggravation de l’hypertension portale, d’encéphalopathie hépatique, de dégénérescence des nodules hépatiques ou des complications de la maladie causale.
2. Garcia-Pagán JC, Valla DC. Primary Budd–Chiari syndrome. N Engl J Med 2023;388(14):1307-16.
3. European Association for the Study of the Liver. EASL clinical practice guidelines: Vascular diseases of the liver. J Hepatol 2016;64:179-202.
4. Murad SD, Plessier A, Hernandez-Guerra M, et al. Etiology, management, and outcome of the Budd-Chiari syndrome. Ann Intern Med 2009;151(3):167-75.
5. Smalberg JH, Arends LR, Valla DC, et al. Myeloproliferative neoplasms in Budd-Chiari syndrome and portal vein thrombosis: A meta-analysis. Blood 2012;120(25):4921-8.
6. Poisson J, Plessier A, Kiladjian JJ, et al. Selective testing for calreticulin gene mutations in patients with splanchnic vein thrombosis: A prospective cohort study. J Hepatol 2017;67(3):501-7.
7. Elkrief L, Payance A, Plessier A, et al. Management of splanchnic vein thrombosis. J HEP Rep 2023;5(4):100667.
8. Recommandations AFEF sur les maladies vasculaires du foie. 2018. https://urls.fr/qP8-yz
9. Dajti E, Ravaioli F, Colecchia A, et al. Liver and spleen stiffness measurements for assessment of portal hypertension severity in patients with Budd Chiari syndrome. Can J Gastroenterol Hepatol 2019;2019:1673197.
10. Dongelmans E, Erler N, Adam R, et al. Recent outcomes of liver transplantation for Budd-Chiari syndrome: A study of the European Liver Transplant Registry (ELTR) and affiliated centers. Hepatology 2024;80(1):136-51.
11. Plessier A, Esposito‐Farèse M, Baiges A, et al. Paroxysmal nocturnal hemoglobinuria and vascular liver disease: Eculizumab therapy decreases mortality and thrombotic complications. Am J Hematol 2022;97(4):431-9.
12. Desbois AC, Rautou PE, Biard L, et al. Behcet’s disease in Budd-Chiari syndrome. Orphanet J Rare Dis 2014;9:104.
13. Franchis R de, Bosch J, Garcia-Tsao G, et al. Baveno VII - Renewing consensus in portal hypertension. J Hepatol 2022;76(4):959-74.
14. Wang Q, Li K, He C, et al. Angioplasty with versus without routine stent placement for Budd-Chiari syndrome: A randomised controlled trial. Lancet Gastroenterol Hepatol 2019;4(9):686-97.
15. Seijo S, Plessier A, Hoekstra J, et al. Good long-term outcome of Budd-Chiari syndrome with a step-wise management. Hepatology 2013;57(5):1962-8.
16. Segev DL, Nguyen GC, Locke JE, et al. Twenty years of liver transplantation for Budd-Chiari syndrome: A national registry analysis. Liver Transplant 2007;13(9):1285-94.
17. Garcia-Pagán JC, Heydtmann M, Raffa S, et al. TIPS for Budd-Chiari syndrome: Long-term results and prognostics factors in 124 patients. Gastroenterology 2008;135(3):808-15.
18. Zeitoun G, Escolano S, Hadencue A, et al. Outcome of Budd-Chiari syndrome: A multivariate analysis of factors related to survival including surgical portosystemic shunting. Hepatology 1999;30(1):84-9.
19. Darwish Murad S, Valla DC, De Groen PC, et al. Determinants of survival and the effect of portosystemic shunting in patients with Budd-Chiari syndrome. Hepatology 2004;39(2):500-8.