Le syndrome douloureux vésical (SDV), en anglais bladder pain syndrome, anciennement appelé cystite interstitielle, est défini par l’European Society for the Study of Interstitial Cystitis (ESSIC) en 2008 comme une douleur ou un inconfort chronique (évoluant depuis six mois) en relation avec la vessie, associée à un (des) symptôme(s) urinaire(s) tel(s) qu’une pollakiurie et/ou une envie permanente d’uriner, en l’absence de pathologie organique.1 Le terme de cystite interstitielle, utilisé autrefois, a aujourd’hui été abandonné car incomplet. En effet, les symptômes perçus par les patients ne sont pas toujours en lien avec la visualisation d’une anomalie inflammatoire de la paroi vésicale. Le SDV a une définition très large qui englobe en réalité des entités ayant des physiopathologies très différentes. Il est donc désormais admis qu’il existe différents sous-groupes de SDV classiquement appelés phénotypes, ayant des particularités et une prise en charge plus ou moins spécifique.2 Il pourrait exister une dizaine de phénotypes, mais cette notion reste débattue.3 En revanche, il est classique d’en distinguer au moins deux (tableau 1) :
- le phénotype « cystopathie de paroi » caractérisé par une atteinte de la paroi vésicale avec lésion endoscopique et anomalie histologique typique, ainsi qu’une capacité vésicale réduite ;
- le phénotype « systémique/sensibilisation » avec une vessie de capacité et d’aspect endoscopique normaux mais « hypersensible ».
Prévalence à prédominance féminine
La prévalence du SDV varie de 3 à 6 % de la population générale,4 avec une nette prédominance féminine (sex-ratio de 4 femmes pour 1 homme).5 La proportion d’hommes atteints est probablement sous-estimée, la prostatite chronique étant le diagnostic différentiel le plus souvent évoqué.6 Le SDV fait partie du groupe des syndromes douloureux pelviens ; il est fréquemment associé à un autre d’entre eux : dans 50 % des cas au syndrome douloureux des muscles du pelvis et du périnée, 38 % au syndrome de l’intestin irritable, 18 % à la fibromyalgie, 17 % aux vulvodynies et 10 % à une fatigue chronique.7 Cette association est volontiers évocatrice d’une sensibilisation pelvi-périnéale, voire centrale, véritable dysfonction nociceptive systémique.
Physiopathologie complexe et mal élucidée
La physiopathologie est mal connue et il existe probablement de nombreux facteurs intervenant dans la genèse de ce syndrome. Plusieurs mécanismes sont actuellement mis en avant : dysfonction de la barrière urothéliale responsable d’une hyperperméabilité permettant le passage de métabolites de micro-organismes présents dans les urines vers le sous-urothélium et conduisant à une inflammation de la paroi vésicale, puis progressivement à une fibrose ; sensibilisation viscérale de la vessie dans le cadre d’une sensibilisation centrale ou périphérique. Les facteurs tels que l’hyperactivité neuronale ou la dérégulation sensitive, ainsi que les troubles extra-vésicaux (hypertonie ou dysfonction du plancher pelvien) joueraient aussi un rôle dans la physiopathologie du SDV.
Inflammation
Dans le SDV, le tissu vésical surexprime de nombreux gènes pro-inflammatoires.8 D’importantes concentrations de lymphocytes,9 d’immunoglobulines, de marqueurs de l’inflammation et de cytokines pro-inflammatoires10 forment des dépôts dans le tissu vésical et sont mises en évidence dans les urines.11 La réponse inflammatoire pourrait être induite par les facteurs suivants :
- les troubles auto-immuns : les patients présentant un terrain auto-immun, comme un syndrome de Gougerot-Sjögren, une thyroïdite d’Hashimoto, une spondylarthrite ankylosante, une polyarthrite rhumatoïde,12 un lupus érythémateux disséminé13 et autres maladies auto-immunes, sont plus sujets au SDV que la population générale. Des dépôts d’anticorps sont parfois retrouvés dans les urines. La réaction inflammatoire serait déclenchée par les agents pathogènes issus des composants cellulaires dégénérés (DAMP) présents dans les pathologies auto-immunes ;
- l’hyperactivation des mastocytes dans la paroi vésicale :14 en synthétisant des cytokines pro-inflammatoires et recrutant des leucocytes, les mastocystes majorent l’inflammation locale et sont responsables d’une néoangiogenèse ainsi que d’une fibrose stromale. Ils participent de même à l’inflammation des nerfs afférents ;
- les infections :15,16 le rôle des infections urinaires et surtout de la modification de la flore bactérienne du tractus urinaire (microbiote) est suggéré comme facteur de réponse inflammatoire.
Dysfonction et défect de la barrière urothéliale
Un défaut d’imperméabilité de la barrière urothéliale, assurée par la couche de glycosaminoglycanes (GAG), favorise le passage et le dépôt de substances présentes dans l’urine, au niveau de la paroi vésicale, majorant ainsi la réponse inflammatoire et provoquant l’hyperactivité des nerfs afférents.17
Mécanismes liés à l’hypersensibilisation et hyperactivité neuronale
Outre les mécanismes périphériques, la douleur peut également impliquer l’activation des neurones de la corne dorsale de la moelle épinière, dans le cadre d’une sensibilisation centrale, véritable dysfonction nociceptive systémique à l’origine de la persistance de la douleur malgré la résolution de l’inflammation ou autre atteinte pelvienne. Ce mécanisme de chronicisation de la douleur survient en réponse à une agression physique et/ou psychologique de l’organisme.18,19
Une activité du système nerveux sympathique accrue est démontrée chez les patients atteints de SDV.
Par ailleurs, une augmentation du volume de la matière grise, observée en IRM cérébrale structurelle chez les patients atteints de SDV, jouerait un rôle dans la perception exacerbée de la douleur.20,21
Les progrès de l’imagerie cérébrale fonctionnelle ont eu un impact sur la compréhension du contrôle par le système nerveux central de la vessie. Des patients diagnostiqués comme souffrant de SDV ont une douleur généralisée répondant au modèle de fonctionnement cérébral également observé chez les patients souffrant de fibromyalgie.22
Comorbidités extravésicales
Les patients atteints de SDV sont susceptibles de présenter d’autres syndromes douloureux et troubles fonctionnels, notamment une dysfonction du plancher pelvien, un syndrome de l’intestin irritable, une fibromyalgie, un syndrome de fatigue chronique ou une migraine.23 Les troubles somatoformes sont des facteurs prédictifs de SDV.
Bilan clinique
Il n’existe pas de test diagnostique spécifique pour le SDV, l’examen vise, d’une part, à identifier ou exclure des pathologies organiques qui constitueraient des diagnostics différentiels, d’autre part, à améliorer la description phénotypique des symptômes. Le bilan clinique comprend un interrogatoire,24 la constitution d’un calendrier mictionnel et un examen physique.
Interrogatoire en quatre points
Définir les caractéristiques de la douleur : il s’agit d’interroger le patient sur les spécificités perçues et les spécificités objectives de sa douleur.25 La sensation peut être perçue comme une douleur, pesanteur, pression, brûlure ou un inconfort lié à la plénitude de la vessie. Principalement localisée dans la région sus-pubienne, une irradiation est possible vers d’autres zones telles que le vagin, l’urètre (à différencier du syndrome douloureux urétral [encadré]), l’aine, le rectum ou le sacrum. Elle peut être permanente ou plus souvent rythmée par le cycle mictionnel, c’est-à-dire au moment du remplissage vésical ou de la miction, avec une envie d’uriner devenant douloureuse lors du remplissage vésical, difficile à différer à cause de la douleur, partiellement et transitoirement soulagée par la miction. Contrairement à la cystite aiguë bactérienne qui provoque des brûlures mictionnelles, la douleur est temporairement soulagée par la miction.
Évaluer le terrain : il s’agit le plus souvent de femmes présentant des pathologies associées (maladies auto-immunes, fibromyalgies, syndrome de l’intestin irritable…), sujettes au stress chronique et/ou à la dépression.
Identifier des facteurs déclenchants : ce peut être des aliments ou boissons,26 le tabac, un traumatisme physique et/ou psychologique, une infection.
Rechercher les signes urologiques associés : il existe fréquemment une dysurie ainsi qu’une pollakiurie associées. L’envie permanente d’uriner, ainsi que la douleur au remplissage vésical expliquent la pollakiurie. En revanche, le symptôme d’urgenturie – aspect brutal et impérieux du besoin d’uriner, qui caractérise le syndrome d’hyperactivité vésicale – n’est pas nécessairement présent. Celui-ci est soudain, difficile à différer par crainte de la fuite urinaire et non du fait de la douleur.
Les questionnaires standardisés peuvent être utiles tels que le Female Genitourinary Pain Index, qui comporte des items sur la localisation, la fréquence et l’intensité de la douleur ainsi que sur les troubles urinaires et la qualité de vie, ou le O’Leary-Sant Interstitial Cystitis Symptom Index, permettant un suivi de l’efficacité des traitements (tableau 2).27
Calendrier mictionnel pour évaluer la capacité vésicale fonctionnelle
Le calendrier mictionnel oriente le diagnostic, par le recueil sur plusieurs jours du nombre quotidien de mictions et des volumes de chacune, permettant d’évaluer la capacité vésicale fonctionnelle. En effet, une pollakiurie à volume constant (souvent faible) associée à une nycturie est évocatrice d’une cystopathie de paroi. À l’inverse, une pollakiurie diurne à volume variable oriente plutôt vers une vessie hypersensible.
Examen clinique
L’examen clinique doit comprendre :
- un examen abdominal, à la recherche d’un site douloureux ou sensible ;
- un examen pelvien (toucher vaginal/toucher rectal après recueil du consentement du patient), qui permet d’évaluer le tonus et la contractilité des muscles du plancher pelvien et de rechercher une zone « gâchette » douloureuse au niveau de la vessie.
Bilan paraclinique
Le SDV est un diagnostic d’exclusion. Il convient donc d’éliminer les diagnostics différentiels potentiellement fréquents, curables ou graves.
Cystoscopie
La cystoscopie est l’examen clé, indispensable devant une symptomatologie de SDV. Elle permet notamment d’éliminer un diagnostic différentiel grave tel que la tumeur de vessie. L’examen est volontiers réalisé au bloc opératoire, sous anesthésie générale ou rachianesthésie, car cela permet d’y associer un test d’hydrodistension et des biopsies en fonction des constatations,1 ainsi qu’une éventuelle électrocoagulation en cas de lésion endoscopique, ce qui peut améliorer les douleurs. Toutefois, lorsque la capacité vésicale fonctionnelle est préservée sur le calendrier mictionnel et qu’un phénotype plutôt systémique/sensibilisation est suspecté, l’hydrodistension pourrait majorer les douleurs ; on peut alors se contenter de proposer une simple cystoscopie sous anesthésie locale.
La cystoscopie comprend une inspection première, à la recherche d’un diagnostic différentiel. Par la suite, lorsqu’elle est réalisée sous anesthésie générale, l’hydrodistension consiste à remplir la vessie sur une courte durée et à une pression de 80 cmH2O. On utilise une poche d’irrigation de sérum physiologique, positionnée à 80 cm au-dessus de la symphyse pubienne, jusqu’à équilibre entre la pression vésicale et la poche de remplissage. La distension est maintenue pendant trois à cinq minutes, puis la vidange est réalisée, permettant la mesure de la capacité vésicale anatomique. Celle-ci est réduite dans le SDV avec cystopathie pariétale du fait d’une fibrose de la paroi vésicale, à l’inverse des formes liées à une sensibilisation pelvienne/centrale.
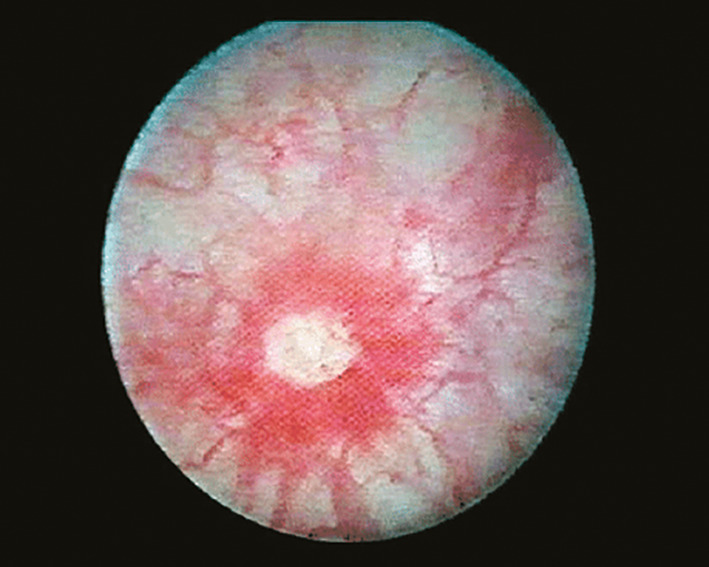
Au cours de la cystoscopie, une exploration attentive de la muqueuse vésicale est effectuée, à la recherche de lésions de la paroi telles que des pétéchies, des glomérulations et des lésions spécifiques appelées ulcères de Hunner (figure, tableau 3). Le SDV de type 3 se caractérise par des zones de muqueuses rouges, souvent associées à de petits vaisseaux irradiant vers une cicatrice centrale, parfois recouvertes d’un petit caillot ou d’un dépôt de fibrine : l’ulcère de Hunner.28,29 La cicatrice se rompt avec l’augmentation de la distension de la vessie, produisant un saignement caractéristique de type cascade. Il existe un lien étroit entre le SDV de type 3 et la réduction de la capacité vésicale sous anesthésie.30 L’apparition de glomérulations après hydrodistension est considérée comme un signe diagnostique positif de SDV, bien que non spécifique31 et non corrélé à l’intensité douloureuse.
Biopsie
Une biopsie peut être envisagée, mais elle n’est pas systématique. Les constatations histologiques, notamment le degré d’infiltration mastocytaire n’est pas spécifique du syndrome douloureux vésical et n’est pas corrélé à la sévérité des symptômes. Cependant, elle présente deux objectifs : le premier est d’exclure un diagnostic différentiel important par examen histologique, tel que le carcinome in situ et la cystite tuberculeuse, le second est de classifier en sous-groupe les SDV (classiques et non lésionnels)32 selon les recommandations de l’ESSIC.
ECBU et échographie
Un examen cytobactériologique des urines (ECBU) et une imagerie type échographie pelvienne et vésicale font souvent partie du bilan de base que tout patient souffrant d’un syndrome douloureux pelvien chronique a déjà eu, a fortiori en cas de symptôme urinaire associé, afin d’éliminer un diagnostic différentiel. La mesure du résidu post-mictionnel permet de dépister un trouble de la vidange vésicale.
Bilan urodynamique
La place du bilan urodynamique est à discuter. Cet examen peut être utile au diagnostic, sous réserve de poser une question pertinente. On peut rechercher une réduction de la capacité vésicale cystomanométrique, le volume de remplissage vésical maximal déclenchant les besoins mictionnels urgents. L’hyperactivité du détrusor, l’hypertonie vésicale et l’instabilité urétrale sont écartées. Plusieurs études ont montré des corrélations entre les paramètres urodynamiques et la sévérité des symptômes, la présence d’ulcère de Hunner, l’intensité des glomérulations ou la capacité vésicale sous anesthésie.
Le bilan urodynamique peut également être utile pour guider la thérapeutique. En effet, la gestion thérapeutique est différente selon qu’il existe ou non une importante hyperactivité détrusorienne ou une hypertonie urétrale.
Prise en charge multimodale
Mesures générales et approche globale
Une approche multidisciplinaire est nécessaire, impliquant différents intervenants (médecin algologue, urologue, psychologue, kinésithérapeute…), permettant d’aboutir le plus souvent à une prise en charge multimodale adaptée à chaque situation, ciblée sur le phénotype. Cette prise en charge est souvent plus efficace qu’un traitement séquentiel ex juvantibus, consistant à essayer tous les traitements les uns à la suite des autres jusqu’à obtenir une efficacité.
Il n’existe pas de traitement curatif de cette maladie chronique, mais de multiples options thérapeutiques symptomatiques visent à améliorer le confort du patient.
L’éducation thérapeutique est primordiale et doit impliquer le patient pour l’aider à comprendre la maladie. Elle vise à déterminer des objectifs réalistes pour soulager, rarement pour guérir : diminuer la douleur, corriger les symptômes urinaires, augmenter l’activité physique, améliorer la qualité de vie.33
Des mesures physiques générales telles que l’application de chaud ou de froid sur les points douloureux et l’éviction de comportements à risque d’exacerbation ou point gâchette douloureux (digestif, vaginal…) peuvent être recommandées, ainsi que le traitement d’une constipation ou une prise en charge de la dyspareunie.
L’activité physique doit être encouragée, avec des exercices sans impact, afin de favoriser le maintien d’un bon état général.
Des facteurs alimentaires déclenchant ou aggravant les symptômes sont décrits par un tiers des patients. Une adaptation nutritionnelle individuelle est donc à recommander, avec éviction des aliments acides et pro-inflammatoires. De manière générale, des mesures hygiénodiététiques telles que l’arrêt du tabac, de l’alcool, du café, du thé, des épices peuvent être employées.34
Traitements non médicamenteux
Rééducation périnéale
Une rééducation périnéale par un kinésithérapeute spécialisé s’oriente sur un travail de relâchement des contractures, avec la réalisation de manœuvres de relaxation des muscles pelviens et la libération d’éventuels points gâchettes douloureux.
Dans une revue sur la kinésithérapie chez les femmes souffrant de douleurs pelviennes, plusieurs essais randomisés ont révélé son efficacité.35 L’un des essais a montré que la thérapie somatocognitive de Mensendieck entraînait une réduction de la douleur de 64 % après un an de suivi. Cette approche consiste en une relaxation des tensions myofasciales, une amélioration de la posture et du mouvement en combinaison avec une thérapie cognitivo-comportementale.
Neurostimulation
Les preuves sont de plus en plus nombreuses concernant la neurostimulation.24 Qu’il s’agisse de la stimulation nerveuse électrique transcutanée (TENS) ou de la neurostimulation tibiale postérieure transcutanée, ce sont des options efficaces et non médicamenteuses, sans effets indésirables. Elles nécessitent généralement un suivi spécialisé régulier ainsi qu’une bonne observance.
La TENS est une technique non invasive utilisée dans de nombreuses affections douloureuses. Des essais cliniques ont démontré une réduction significative de la douleur après douze semaines de traitement pour des douleurs telles que la dysménorrhée et le syndrome douloureux pelvien chronique.36,37 Les effets bénéfiques d’un traitement par TENS peuvent être durables.
Traitements médicamenteux oraux
Les traitements classiques tels que les antibiotiques, anti-inflammatoires et anticholinergiques sont souvent prescrits mais peu efficaces dans la prise en charge du SDV.
Les anticholinergiques ne sont efficaces sur l’hyperactivité vésicale que si l’on obtient un bon contrôle de la douleur au préalable car, dans le SDV, les mictions sont fréquentes, principalement pour éviter la douleur.
Les antibiotiques, trop souvent utilisés, permettent une amélioration souvent transitoire liée à un possible effet anti-inflammatoire et analgésique, mais ne représentent pas une solution à long terme. Il existe potentiellement un lien entre le microbiome et le SDV. Les patients qui souffrent de SDV présentent souvent une hypersensibilité à toute infection.
Les antalgiques de palier 1 sont inefficaces dans le SDV, et on fait volontiers appel aux molécules de palier 2 comme le tramadol ou le néfopam.
Il convient d’éviter l’usage des opioïdes morphiniques qui aggravent les mécanismes de l’hypersensibilisation.
L’amitriptyline est le traitement de la sensibilisation centrale de première ligne ; elle est prescrite à doses progressives afin d’éviter les effets indésirables comme la sédation ou les nausées et d’obtenir la dose minimale efficace. En cas d’échec, les inhibiteurs de la recapture de la sérotonine et de la noradrénaline sont indiqués (duloxétine ou venlafaxine), également instaurés à doses progressives.
Le polysulfate de pentosaneper os est le seul traitement disposant d’une autorisation de mise sur le marché (AMM) spécifique pour le SDV. Par son mécanisme d’action, il renforce la couche de GAG au niveau de la paroi vésicale, permettant ainsi de restaurer la couche protectrice tapissant l’urothélium. Il permet d’obtenir une amélioration, chez la moitié des patients, de la douleur, de l’urgenturie, de la pollakiurie, mais pas de la nycturie.38,39 Les effets indésirables comprennent notamment l’alopécie ainsi que la survenue de crampes et de nausées. L’efficacité du traitement est davantage liée à sa durée qu’à la posologie (classiquement 100 mg trois fois par jour). L’inconvénient majeur est lié à la mauvaise tolérance : un examen ophtalmologique doit être réalisé avant l’introduction du traitement, en raison du risque de maculopathie pigmentaire, et répété à cinq ans si le traitement est poursuivi. Les essais randomisés ayant démontré une efficacité incluaient uniquement des SDV de phénotype « cystopathie pariétale » avec réduction de la capacité vésicale et lésion endoscopique. Ce traitement doit donc idéalement être réservé à ce sous-groupe de patients.
Les antihistaminiques tels que l’hydroxyzine ou la cimétidine peuvent être une option en cas de terrain allergique.
Les antagonistes des récepteurs anti-histaminiques H2 ont également montré une efficacité sur le contrôle des symptômes urinaires et de la douleur chez 44 à 57 % des patients, sans effet indésirable significatif. Il n’existe cependant pas de consensus concernant sa posologie, et sa prescription se fait hors autorisation de mise sur le marché.
Thérapies intravésicales
Les thérapies intravésicales utilisent des molécules à faible biodisponibilité par voie orale. Leur administration intravésicale permet d’obtenir une concentration élevée localement, avec peu d’effets indésirables systémiques. Leurs inconvénients résident dans la nécessité d’un cathétérisme intermittent, parfois douloureux chez les patients atteints de SDV, leur coût et le risque d’infection.
Diméthylsulfoxyde
L’instillation de diméthylsulfoxyde, ou DMSO, dispose d’une autorisation d’accès compassionnel. Elle est indiquée après échec des traitements par amitriptyline ou polysulfate de pentosane. Elle est administrée à raison de 50 mL en instillation intravésicale, durant quinze minutes, toutes les deux semaines, puis de manière plus espacée après régression des symptômes. Le DMSO a un effet anesthésique local, anti-inflammatoire, bactériostatique. Il permettrait d’améliorer les symptômes de 30 à 90 % des patients.40 Ses principaux inconvénients sont la nécessité d’administration en milieu hospitalier et le caractère souvent douloureux des instillations.
Acide hyaluronique et/ou sulfate de chondroïtine
Les instillations hebdomadaires d’acide hyaluronique et de chondroïtine sulfate ont été proposées afin de restaurer le revêtement de GAG, avec une efficacité qui semble comparable à celle du DMSO, associée à un effet rémanent. Ce traitement présente l’avantage d’avoir une excellente tolérance avec un profil de patients pouvant être élargi aux cystites récidivantes ou post radiques. Cependant, très peu d’études de niveau de preuve élevé ont démontré leur efficacité.41 Aucun de ces produits n’est aujourd’hui remboursé.
Lidocaïne et bicarbonate de sodium
Les injections de lidocaïne associée à du bicarbonate de sodium intravésicales ont montré dans quelques études une amélioration de la symptomatologie.42,43 94 % des patients sont soulagés immédiatement et 80 % présentent une amélioration durable après deux semaines.33 Les auto-instillations peuvent être utilisées en protocole de désensibilisation vésicale.
Hydrodistension
L’hydrodistension peut être choisie comme traitement de première ligne. Elle peut améliorer la symptomatologie chez les patients atteints de syndrome douloureux vésical, comme le rapporte l’étude d’Ottem et al. :44 sur une cohorte de 84 patients présentant un SDV, 65 % de ceux ayant eu une hydrodistension ont ressenti une amélioration contre 25 % des patients n’en ayant pas eue. Les symptômes sont améliorés pendant environ deux mois. Indiscutablement, une partie des patients en bénéficient, parfois sur de longues durées, permettant de proposer ce traitement dans certains cas, de manière itérative.
Électrocoagulation ou fulguration des lésions de Hunner
La destruction par électrocoagulation ou fulguration des lésions de Hunner améliore considérablement les symptômes chez 75 à 86 % des patients, et ce durablement (au moins trois ans).45
Toxine botulinique A
Les injections de toxine botulinique A, réalisées au cours d’une hydrodistension, permettraient d’améliorer les symptômes de manière significative pour environ 75 % des patients à trois mois.33 Les patients doivent avoir été prévenus du risque de rétention d’urine et préalablement éduqués aux autosondages propres intermittents.
Adressage en cas d’échec
En cas d’échec des thérapies conservatrices, il convient d’adresser le patient en centre expert référent de la douleur pelvi-périnéale. Le traitement chirurgical est réservé au dernier recours, uniquement s’il existe une cystopathie pariétale évoluée et que la douleur est améliorée par instillation intravésicale d’anesthésique local.
Traitement chirurgical
Le traitement chirurgical radical garde de rares indications en situation d’échec des thérapies conservatrices. La chirurgie trouve sa place chez des patients sélectionnés, en dernier recours, uniquement s’il existe une cystopathie pariétale évoluée, avec une capacité vésicale nettement réduite. Il convient de prendre en charge le patient en centre expert de la douleur pelvi-périnéale car elle nécessite une gestion périopératoire de la douleur.
La cystectomie sus-trigonale associée à une entérocystoplastie a montré de bons résultats sur la régression des symptômes sur le long terme46. La réalisation d’une cystectomie totale est controversée, mais semble être préférable si la douleur prédomine au niveau urétral.47
Une dérivation urinaire non continente de type Bricker peut être proposée, notamment chez les patients ayant une pollakiurie très importante, de même qu’une dérivation urinaire continente de type Miami/Indiana avec vidange du néoréservoir par des autosondages intermittents via une cystostomie continente.
Les traitements chirurgicaux proposés restent invasifs et potentiellement morbides. Les patients doivent être informés du risque de persistance de douleurs, du caractère irréversible de l’intervention, du risque de complication chirurgicale,48 et doivent en outre être en capacité de réaliser des autosondages propres intermittents en cas d’entérocystoplastie.
Pathologie multifactorielle
Le syndrome douloureux vésical fait partie des syndromes douloureux pelviens et est fréquemment associé à un autre d’entre eux. Il s’agit d’une pathologie multifactorielle, qu’il convient d’appréhender de manière globale et multidisciplinaire. Le diagnostic est essentiellement clinique, associé à la réalisation d’une cystoscopie. La prise en charge est multimodale, avec un panel de traitements médicamenteux ou non médicamenteux, dont le choix est guidé par les spécificités du patient. Une meilleure compréhension des mécanismes sous-jacents permettrait de proposer un traitement individualisé, spécifique du phénotype de SDV.
Syndrome douloureux urétral
Il correspond à l’apparition d’une douleur chronique récurrente perçue au niveau de l’urètre, en l’absence d’infection avérée ou d’autre pathologie locale évidente. Touchant aussi bien les hommes que les femmes, il est souvent associé à des troubles du bas appareil urinaire, notamment à une dysurie, ainsi qu’à des troubles génito-sexuels (dyspareunie, vulvodynie, douleurs à l’éjaculation).
2. Nickel JC. Individualized treatment strategy for bladder pain syndrome in female patients provides treatment recipes for successful management. Prog Urol. J Assoc Francaise Urol Soc Francaise Urol 2023;33(7):359‑61.
3. Nickel JC. Managing interstitial cystitis/bladder pain syndrome in female patients: Clinical recipes for success. Can Urol Assoc J. J Assoc Urol Can 2022;16(12):393‑8.
4. Berry SH, Elliott MN, Suttorp M, et al. Prevalence of symptoms of bladder pain syndrome/interstitial cystitis among adult females in the United States. J Urol 2011;186(2):540‑4.
5. Clemens JQ, Meenan RT, Rosetti MCO, et al. Prevalence and incidence of interstitial cystitis in a managed care population. J Urol 2005;173(1):98‑102; discussion 102.
6. Clemens JQ, Clauw DJ, Kreder K, et al. Comparison of baseline urological symptoms in men and women in the MAPP research cohort. J Urol 2015;193(5):1554‑8.
7. Nickel JC, Tripp DA, Pontari M, et al. Psychosocial phenotyping in women with interstitial cystitis/painful bladder syndrome: A case control study. J Urol 2010;183(1):167‑72.
8. Jhang JF, Jiang YH, Kuo HC. Current understanding of the pathophysiology and novel treatments of interstitial cystitis/bladder pain syndrome. Biomedicines 2022;10(10):2380.
9. Maeda D, Akiyama Y, Morikawa T, et al. Hunner-type (classic) interstitial cystitis: A distinct inflammatory disorder characterized by pancystitis, with frequent expansion of clonal B-cells and epithelial denudation. PLoS ONE 2015;10(11):e0143316.
10. Jiang YH, Peng CH, Liu HT, et al. Increased pro-inflammatory cytokines, C-reactive protein and nerve growth factor expressions in serum of patients with interstitial cystitis/bladder pain syndrome. PLoS ONE 2013;8(10):e76779.
11. Shie JH, Kuo HC. Higher levels of cell apoptosis and abnormal E-cadherin expression in the urothelium are associated with inflammation in patients with interstitial cystitis/painful bladder syndrome. BJU Int 2011;108(2 Pt 2):E136-141.
12. Yueh HZ, Yang MH, Huang JY, et al. Risk of autoimmune diseases in patients with interstitial cystitis/bladder pain syndrome: A nationwide population-based study in Taiwan. Front Med 2021;8:747098.
13. Wen JY, Lo TS, Chuang YC, et al. Risks of interstitial cystitis among patients with systemic lupus erythematosus: A population-based cohort study. Int J Urol. Off J Jpn Urol Assoc 2019;26(9):897‑902.
14. Tyagi P, Moon CH, Janicki J, et al. Recent advances in imaging and understanding interstitial cystitis. F1000 Research 2018;7:1771.
15. Abernethy MG, Rosenfeld A, White JR, et al. Urinary microbiome and cytokine levels in women with interstitial cystitis. Obstet Gynecol 2017;129(3):500.
16. Siddiqui H, Lagesen K, Nederbragt AJ, et al. Alterations of microbiota in urine from women with interstitial cystitis. BMC Microbiol 2012;12:205.
17. Lopez SR, Mangır N. Current standard of care in treatment of bladder pain syndrome/interstitial cystitis. Ther Adv Urol 2021;13:175628722110224.
18. Kanter G, Komesu YM, Qaedan F, et al. Mindfulness-based stress reduction as a novel treatment for interstitial cystitis/bladder pain syndrome: A randomized controlled trial. Int Urogynecology J 2016;27(11):1705‑11.
19. Lutgendorf SK, Kreder KJ, Rothrock NE, et al. Stress and symptomatology in patients with interstitial cystitis: A laboratory stress model. J Urol 2000;164(4):1265‑9.
20. Kairys AE, Schmidt-Wilcke T, Puiu T, et al. Increased brain gray matter in the primary somatosensory cortex is associated with increased pain and mood disturbance in patients with interstitial cystitis/painful bladder syndrome. J Urol 2015;193(1):131‑7.
21. Kilpatrick LA, Kutch JJ, Tillisch K, et al. Alterations in resting state oscillations and connectivity in sensory and motor networks in women with interstitial cystitis/painful bladder syndrome. J Urol 2014;192(3):947‑55.
22. Kutch JJ, Ichesco E, Hampson JP, et al. Brain signature and functional impact of centralized pain: A multidisciplinary approach to the study of chronic pelvic pain (MAPP) network study. Pain 2017;158(10):1979‑91.
23. Jhang JF, Jiang YH, Kuo HC. Current understanding of the pathophysiology and novel treatments of interstitial cystitis/bladder pain syndrome. Biomedicines 2022;10(10):2380.
24. Fariello JY, Whitmore K. Sacral neuromodulation stimulation for IC/PBS, chronic pelvic pain, and sexual dysfunction. Int Urogynecology J 2010;21(12):1553‑8.
25. Uroweb. European Association of Urology. EAU guidelines on chronic pelvic pain-diagnostic evaluation.
26. Warren JW, Brown J, Tracy JK, et al. Evidence-based criteria for the pain of interstitial cystitis/painful bladder syndrome in women. Urology 2008;71(3):444‑8.
27. O’Leary MP, Sant GR, Fowler FJ, et al. The interstitial cystitis symptom index and problem index. Urology 1997;49(5A Suppl):58‑63.
28. Fall M, Johansson SL, Aldenborg F. Chronic interstitial cystitis: A heterogeneous syndrome. J Urol 1987;137(1):35‑8.
29. Powell TO. Hunner ulcer; report of cases. West J Surg Obstet Gynecol 1950;58(3):118‑29.
30. Messing E, Pauk D, Schaeffer A, et al. Associations among cystoscopic findings and symptoms and physical examination findings in women enrolled in the Interstitial Cystitis Data Base (ICDB) study. Urology 1997;49(5A Suppl):81‑5.
31. Waxman JA, Sulak PJ, Kuehl TJ. Cystoscopic findings consistent with interstitial cystitis in normal women undergoing tubal ligation. J Urol 1998;160(5):1663‑7.
32. Geurts N, Van Dyck J, Wyndaele JJ. Bladder pain syndrome: Do the different morphological and cystoscopic features correlate? Scand J Urol Nephrol 2011;45(1):20‑3.
33. Giannantoni A, Bini V, Dmochowski R, et al. Contemporary management of the painful bladder: A systematic review. Eur Urol 2012;61(1):29‑53.
34. Shorter B, Lesser M, Moldwin RM, et al. Effect of comestibles on symptoms of interstitial cystitis. J Urol 2007;178(1):145‑52.
35. Loving S, Nordling J, Jaszczak P, et al. Does evidence support physiotherapy management of adult female chronic pelvic pain? A systematic review. Scand J Pain 2012;3(2):70‑81.
36. Cottrell AM, Schneider MP, Goonewardene S, et al. Benefits and harms of electrical neuromodulation for chronic pelvic pain: A systematic review. Eur Urol Focus 2020;6(3):559‑71.
37. Tutolo M, Ammirati E, Heesakkers J, et al. Efficacy and safety of sacral and percutaneous tibial neuromodulation in non-neurogenic lower urinary tract dysfunction and chronic pelvic pain: A systematic review of the literature. Eur Urol 2018;73(3):406‑18.
38. Hwang P, Auclair B, Beechinor D, et al. Efficacy of pentosan polysulfate in the treatment of interstitial cystitis: A meta-analysis. Urology 1997;50(1):39‑43.
39. Mulholland SG, Hanno P, Parsons CL, et al. Pentosan polysulfate sodium for therapy of interstitial cystitis. A double-blind placebo-controlled clinical study. Urology 1990;35(6):552‑8.
40. Gaullier M, Tricard T, Mouracade P, et al. Le diméthyl sulfoxide (DMSO) sous anesthésie générale : une alternative après échec du DMSO sans anesthésie dans le syndrome de la douleur vésicale ? Prog En Urol 2018;28(7):382‑6.
41. Cervigni M, Sommariva M, Tenaglia R, et al. A randomized, open-label, multicenter study of the efficacy and safety of intravesical hyaluronic acid and chondroitin sulfate versus dimethyl sulfoxide in women with bladder pain syndrome/interstitial cystitis. Neurourol Urodyn 2017;36(4):1178-86.
42. Asklin B, Cassuto J. Intravesical lidocaine in severe interstitial cystitis. Case report. Scand J Urol Nephrol 1989;23(4):311‑2.
43. Henry R, Patterson L, Avery N, et al. Absorption of alkalized intravesical lidocaine in normal and inflamed bladders: A simple method for improving bladder anesthesia. J Urol 2001;165(6 Pt 1):1900‑3.
44. Ottem DP, Teichman JMH. What is the value of cystoscopy with hydrodistension for interstitial cystitis? Urology 2005;66(3):494‑9.
45. Ko KJ, Cho WJ, Lee YS, et al. Comparison of the efficacy between transurethral coagulation and transurethral resection of hunner lesion in interstitial cystitis/bladder pain syndrome patients: A prospective randomized controlled trial. Eur Urol 2020;77(5):644‑51.
46. van OA, Oberpenning F, Hertle L. Long-term results of trigone-preserving orthotopic substitution enterocystoplasty for interstitial cystitis. J Urol 2002;167(2 Part 1):603‑7.
47. Mateu Arrom L, Gutiérrez Ruiz C, Mayordomo Ferrer O, et al. Long-term follow-up after cystectomy for bladder pain syndrome: Pain status, sexual function and quality of life. World J Urol 2019;37(8):1597‑603.
48. Andersen AV, Granlund P, Schultz A, et al. Long-term experience with surgical treatment of selected patients with bladder pain syndrome/interstitial cystitis. Scand J Urol Nephrol 2012;46(4):284‑9.

 Encadrés
Encadrés