La thrombose de la veine porte (TVP) se caractérise par l’obstruction, le plus souvent par un thrombus, de la veine porte et/ou de ses branches portales (droite et/ou gauche). Cette obstruction peut être partielle ou complète, récente (moins de six mois) ou chronique (plus de six mois) et peut également affecter les vaisseaux splanchniques qui s’y drainent, tels que la veine mésentérique supérieure, la veine mésentérique inférieure et la veine splénique. En l’absence de reperméabilisation de la veine porte à la suite d’une thrombose récente, il est possible qu’un réseau de veines collatérales, nommé « cavernome », se forme. La prise en charge étant différente, il est important de distinguer la TVP de l’obstruction portale par envahissement tumoral de la veine porte (appelée parfois de manière inappropriée « thrombose tumorale de la veine porte »).
Plus fréquente en cas d’association à une cirrhose
La TVP peut survenir en l’absence d’hépatopathie chronique sous-jacente ou peut compliquer une maladie chronique du foie, le plus souvent une cirrhose ou plus rarement une maladie vasculaire portosinusoïdale (lire l’article « Atteintes des petits vaisseaux » page 1094).
La TVP sans hépatopathie chronique sous-jacente est une maladie rare, avec une incidence annuelle de 0,3 à 2,5 cas pour 100 000 habitants.1 Elle est le plus souvent causée par un état prothrombotique.
Chez les malades atteints de cirrhose, la TVP est un événement relativement fréquent, avec une incidence cumulée de 5 %, 8 %, et 10 % à respectivement un an, trois ans et cinq ans.2
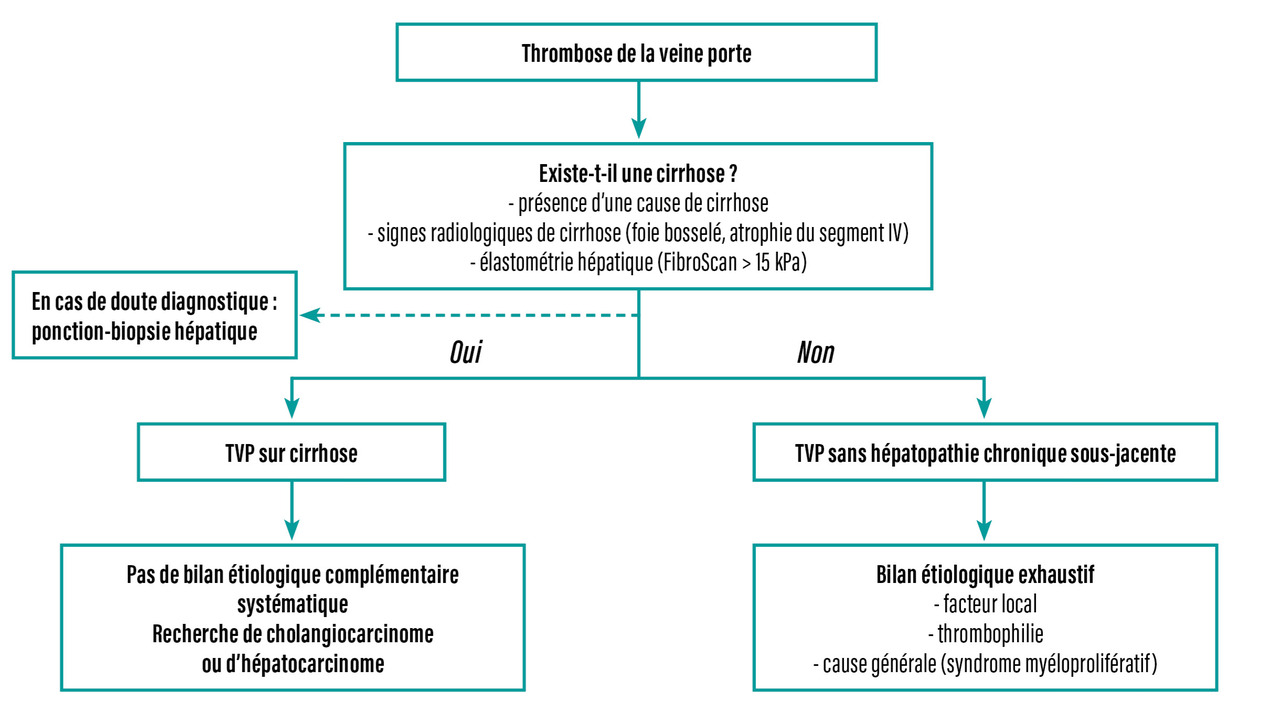
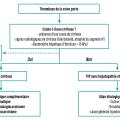
Lors du diagnostic initial, il est donc important de faire la distinction entre une TVP sans hépatopathie chronique sous-jacente et une TVP associée à une cirrhose, car la prise en charge et le pronostic sont différents (fig. 1).
Deux grands types de cause
L’étiologie diffère selon qu’il existe ou non une hépatopathie sous-jacente.
TVP sans hépatopathie sous-jacente
Les facteurs de risque de TVP sans hépatopathie sous-jacente comprennent les facteurs généraux et les facteurs locaux.
Les facteurs généraux, présents chez environ la moitié des patients, comprennent le syndrome myéloprolifératif, qui doit être systématiquement dépisté (par une recherche de la mutation JAK2 V617F en première intention), les thrombophilies héréditaires (mutation du gène de la prothrombine, mutation du facteur V Leiden, déficit en antithrombine) et le syndrome des antiphospholipides (SAPL). Le rôle des facteurs hormonaux (contraception orale œstroprogestative, grossesse) est moins clair que pour le syndrome de Budd-Chiari.3
Les facteurs locaux, présents chez 20 % des patients, comprennent les pathologies infectieuses, inflammatoires ou malignes intra-abdominales (comme une pancréatite, une appendicite, une cholécystite, ou après une intervention de chirurgie abdominale). L’obésité androïde est également un facteur associé à la TVP sans hépatopathie sous-jacente ; elle est observée chez 45 % des patients avec TVP sans cause retrouvée.4
Aucune cause n’est retrouvée pour 15 à 40 % des patients.
Cirrhose
Chez les malades atteints de cirrhose, la prévalence de la TVP est variable et augmente avec la sévérité de la cirrhose : 10 % chez les patients atteints de cirrhose compensée, 17 % chez les patients atteints de cirrhose décompensée et jusqu’à 26 % chez les candidats à une transplantation hépatique.2
Les principaux facteurs de risque de TVP sur cirrhose sont les signes reflétant la gravité de l’hypertension portale, notamment la présence de varices œsophagiennes de grande taille et une thrombopénie. Un ralentissement du flux sanguin dans la veine porte (inférieur à 15 cm par seconde) a également été rapporté, de même que des éléments du syndrome métabolique (obésité, diabète).2 Chez les malades atteints de cirrhose, la TVP est très rarement associée à un état prothrombotique : pour cette raison, la recherche systématique d’une thrombophilie n’est pas justifiée.
Circonstances et modalités diagnostiques
Le diagnostic est évoqué devant des signes cliniques et biologiques ; il est confirmé par l’imagerie.
Manifestations abdominales, le plus souvent
En cas de de TVP récente, la douleur abdominale est le symptôme le plus fréquent, présent chez 91 % des patients. Elle est associée à de la fièvre et/ou à un syndrome inflammatoire biologique (élévation de la protéine C réactive [CRP] et hyperleucocytose dans 85 % des cas).3 Les anomalies des tests hépatiques ne sont pas systématiques ; si elles existent, elles sont modérées et transitoires. Une ascite minime (infraclinique, diagnostiquée à l’imagerie) est présente dans la moitié des cas et n’est pas un signe de sévérité. Rarement, les patients présentent des signes d’irritation péritonéale, une défaillance d’organe, une ascite clinique (abondante et plus rare) et/ou une élévation de la lactatémie artérielle (supérieure à 2 mmol/L). Ces signes de gravité doivent être systématiquement recherchés car ils sont un signe de souffrance intestinale associée (ischémie mésentérique).
La TVP chronique est le plus souvent diagnostiquée devant des signes d’hypertension portale : varices œsophagiennes, splénomégalie, thrombopénie. Dans 30 % des cas, la TVP chronique est diagnostiquée de manière fortuite sur un examen d’imagerie.
La cholangiopathie portale est une complication plus rare de la TVP chronique sans hépatopathie sous-jacente. Elle correspond à des anomalies des voies biliaires dues à la compression des canaux biliaires par le cavernome et/ou à des lésions ischémiques de l’arbre biliaire. Les manifestations sont le plus souvent limitées à des anomalies modérées des tests hépatiques. Les complications cliniques à type d’angiocholite, de pancréatite, d’ictère ou de prurit sont beaucoup plus rares.
Chez les malades atteints de cirrhose, la TVP est le plus souvent diagnostiquée sur un examen d’imagerie réalisé dans le cadre du dépistage du carcinome hépatocellulaire.5 Les douleurs abdominales sont rares (10 % des cas).6 Même si la TVP est associée à la sévérité de la cirrhose, elle n’est pas un facteur précipitant de la décompensation de la cirrhose.2
Diagnostic reposant sur l’imagerie
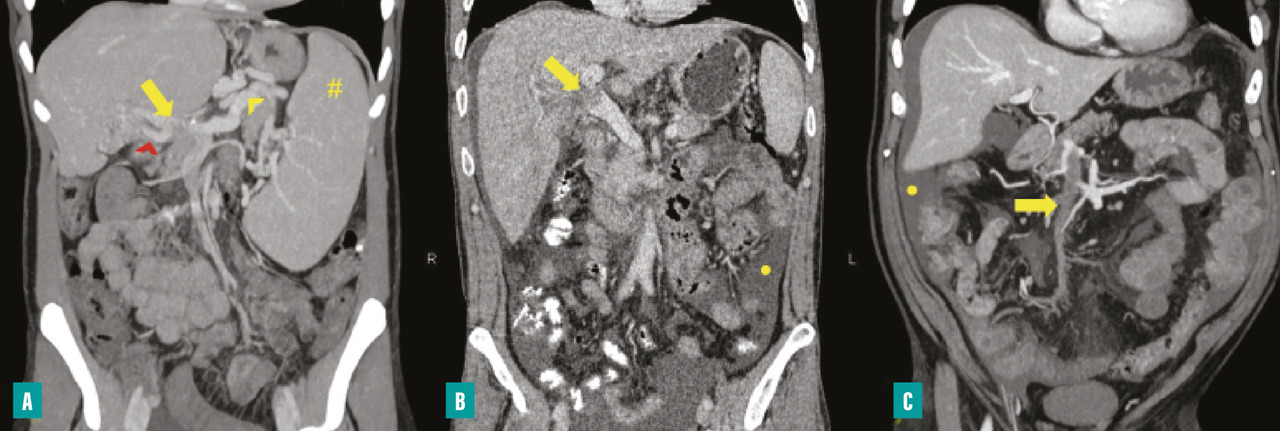
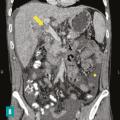
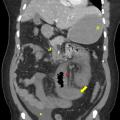
Le diagnostic de TVP récente repose sur l’imagerie. Elle doit être réalisée chez tout patient qui en présente une suspicion clinique. L’échographie-Doppler est généralement l’examen de première intention ; elle permet la visualisation directe du thrombus dans la veine porte et l’absence de flux au Doppler en cas de TVP complète (sensibilité de 88 à 98 %, spécificité de 80 à 100 %). Elle doit être complétée systématiquement par un scanner (ou une imagerie par résonance magnétique [IRM]) abdominal avec injection de produit de contraste, et aux quatre temps d’acquisition (sans injection, phase artérielle, portale et tardive), si cette imagerie n’a pas été réalisée d’emblée. Le scanner permet de confirmer le diagnostic de TVP, de déterminer le degré d’extension aux veines spléniques et mésentériques, de rechercher un facteur local et des signes d’ischémie mésentérique. De plus, il permet d’identifier des signes d’hépatopathie chronique sous-jacente (dysmorphie hépatique, signes d’hypertension portale) [fig. 2].
Le diagnostic de TVP chronique repose également sur le scanner (ou l’IRM) avec injection de produit de contraste, mettant en évidence l’absence de visualisation de la veine porte, généralement remplacée par un cavernome.
La cholangio-IRM (ou bili-IRM) associée à l’IRM hépatique avec injection de produit de contraste est l’examen de référence pour le diagnostic de cholangiopathie portale. Elle permet de visualiser les collatérales veineuses comprimant les voies biliaires ainsi que les modifications du calibre des voies biliaires pathologiques.
Bilan étiologique
Le bilan étiologique dépend de la présence ou non d’une hépatopathie chronique sous-jacente. Le diagnostic d’une cirrhose peut le plus souvent être posé de manière non invasive : il repose sur la présence d’une cause de cirrhose, de signes cliniques, biologiques ou radiologiques de cirrhose (atrophie du segment IV du foie et foie de contours bosselés) et/ou d’une dureté hépatique élevée en élastométrie. Ainsi, une biopsie hépatique n’est généralement réalisée que si les méthodes non invasives ne peuvent affirmer ou écarter une cirrhose, ou en cas de suspicion de maladie vasculaire portosinusoïdale.7
En cas de TVP sans hépatopathie chronique sous-jacente, le bilan étiologique doit comprendre la recherche d’un facteur général et d’un facteur local. La combinaison de facteurs généraux et locaux est fréquente (plus de 30 % des cas), ce qui justifie un bilan exhaustif, même lorsque des facteurs prédisposants ou précipitants sont mis en évidence (fig. 1). En effet, la présence d’un état prothrombotique modifie la prise en charge car elle conditionne les modalités du traitement anticoagulant, et le traitement du facteur causal est important pour limiter le risque de récidive de la TVP.4,8
En cas de TVP sur cirrhose, la recherche systématique de facteurs de risque de thrombose n’est pas recommandée.
Prise en charge
Anticoagulation
Le traitement anticoagulant est différent selon l’existence d’une hépatopathie chronique sous-jacente ou non.
En l’absence d’hépatopathie chronique sous-jacente
En cas de TVP récente, le traitement anticoagulant doit être introduit en urgence. Il permet de prévenir l’extension du thrombus et de diminuer le risque d’ischémie et d’infarctus mésentérique.3 La reperméabilisation spontanée sans anticoagulants est exceptionnelle. L’administration précoce des anticoagulants (dans les vingt-quatre heures après le diagnostic radiologique) est un facteur associé à la reperméabilisation complète de la veine porte.9
Le traitement anticoagulant repose sur une héparine de bas poids moléculaire (HBPM) relayée secondairement par une anticoagulation orale. Les héparines non fractionnées doivent si possible être évitées car il existe un risque élevé de thrombopénie induite par l’héparine dans ce contexte. La reperméabilisation des veines thrombosées, obtenue pour environ 30 % des patients traités par anticoagulation, a lieu dans la grande majorité des cas dans les six premiers mois de traitement.3 Par conséquent, le traitement anticoagulant initial doit durer au moins six mois chez les patients avec TVP récente.
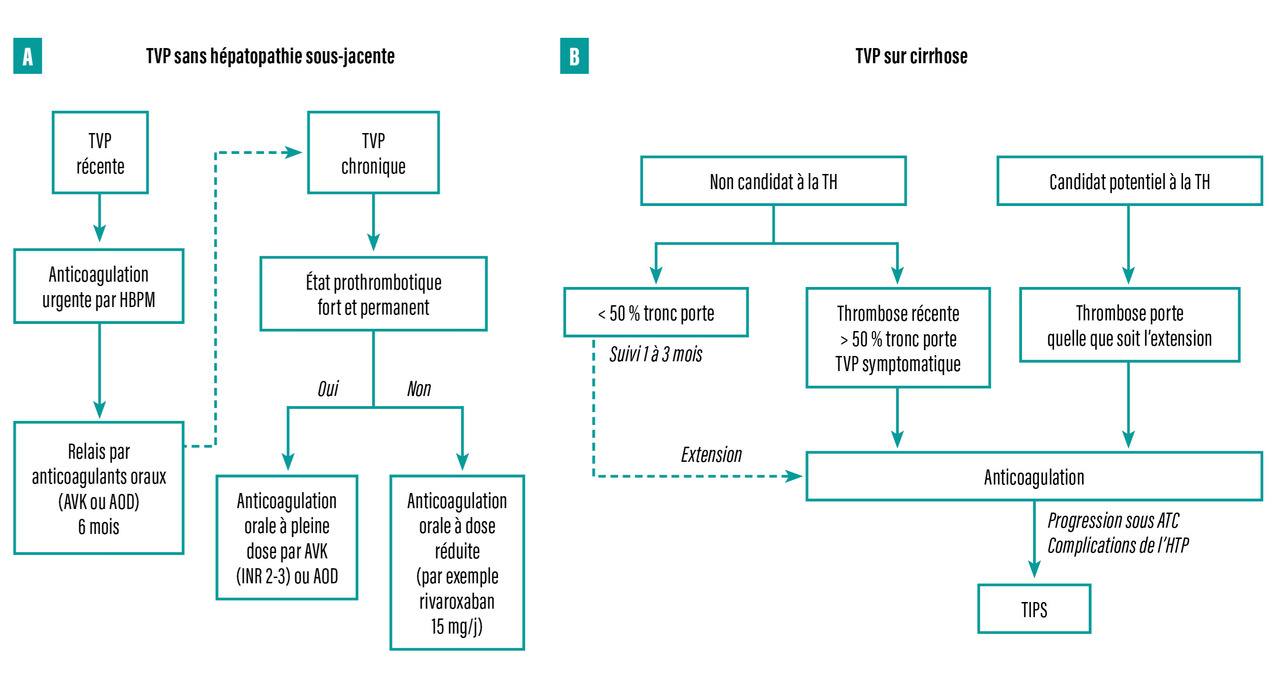
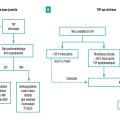
Six mois après une TVP récente ou en cas de TVP chronique, un traitement anticoagulant au long cours est indiqué dans la majorité des cas, car il est associé à une réduction des récidives de thrombose dans le territoire splanchnique ou extrasplanchnique.10 (fig. 3)
Les options de traitement anticoagulant oral comprennent les antivitamines K (AVK), avec pour objectif un international normalized ratio (INR) entre 2 et 3, et les anticoagulants oraux directs (AOD). Les AOD sont contre-indiqués en cas de syndrome des antiphospholipides (SAPL) triple positif ou de grossesse. Ils doivent être utilisés avec prudence en cas d’insuffisance rénale ou d’insuffisance hépatique aiguë. Leur efficacité semble similaire à celle des HBPM et supérieure à celle des AVK, sans augmentation du risque hémorragique.11 La dose du traitement anticoagulant doit être déterminée au cas par cas. Elle prend en compte le site de la thrombose initiale, sa gravité, la présence de facteurs de risque permanents et forts de thrombose (syndrome myéloprolifératif, hémoglobinurie paroxystique nocturne, maladie de Behçet, SAPL, antécédents personnels ou familiaux au premier degré de thrombose veineuse spontanée), le risque hémorragique et le projet thérapeutique du patient.7
Ainsi, en cas de TVP sans hépatopathie chronique sous-jacente ni facteur de risque fort de thrombose, un traitement anticoagulant au long cours à dose réduite (rivaroxaban 15 mg/j) permet de réduire le risque de récidive de thrombose sans augmenter le risque hémorragique.12
En cas de cirrhose associée
Chez les malades atteints de cirrhose, le principal enjeu concerne les malades en attente de transplantation hépatique. En effet, la TVP est associée à une morbi-mortalité accrue après la greffe, particulièrement chez les malades ayant une TVP complète et étendue, chez lesquels une anastomose porto-porte n’est pas possible.13 Pour les malades atteints de cirrhose, bien que la reperméabilisation spontanée puisse survenir, celle-ci est plus fréquemment observée chez les malades traités par anticoagulants.14 Pour cette raison, il est recommandé de traiter les malades par anticoagulants en cas de projet (y compris un projet potentiel) de transplantation hépatique,7 l’objectif étant de permettre/faciliter l’anastomose porte en cas de transplantation hépatique. De plus, une méta-analyse de données individuelles portant sur 500 malades ayant une TVP a montré que le traitement anticoagulant était associé à une amélioration du pronostic.15 Ainsi, même en l’absence de projet de transplantation hépatique, le traitement anticoagulant doit être envisagé, en particulier en cas de TVP étendue (plus de 50 % d’occlusion ou étendue à la veine mésentérique supérieure). Les recommandations d’anticoagulation sont résumées dans la figure 3.
Il n’y a pas actuellement de recommandation forte quant au choix de l’anticoagulant en cas de TVP chez les malades atteints de cirrhose. Les AOD sont de plus en plus fréquemment utilisés et ne semblent pas aggraver le risque hémorragique.17 Ils doivent néanmoins être utilisés avec prudence en cas d’insuffisance hépatique ou rénale.7,18 Leur efficacité et leur tolérance semblent aussi bonnes que celles des HBPM et meilleures que celles des AVK.16
Traitement de l’hypertension portale
En cas de TVP sans hépatopathie chronique sous-jacente, les critères non invasifs (dureté hépatique et taux de plaquettes) ne sont plus valables et ne permettent pas d’écarter les varices à risque de saignement. Une endoscopie digestive haute doit être réalisée systématiquement pour le dépistage des varices gastro-œsophagiennes. Après une TVP récente, et en l’absence de reperméabilisation, l’endoscopie digestive haute doit être répétée dans l’année car les varices gastro-œsophagiennes peuvent se développer rapidement. En cas de TVP chronique, la surveillance (rythme des endoscopies) et le traitement pour la prophylaxie de l’hémorragie digestive par rupture de varices se font selon les mêmes modalités que chez les malades atteints de cirrhose.7 Les ligatures peuvent être effectuées chez les patients traités par anticoagulants sans augmentation du risque hémorragique.19
Chez les malades atteints de cirrhose, la présence d’une TVP ne modifie pas les modalités de surveillance de l’hypertension portale. En cas d’hémorragie digestive récidivante, la présence d’une TVP peut être un argument en faveur de la mise en place d’un shunt porto-cave intrahépatique transjugulaire (TIPS).20
Radiologie et endoscopie interventionnelles
Pour la TVP chronique sans hépatopathie chronique sous-jacente, la recanalisation de la veine porte par voie radiologique doit être envisagée en cas de complications réfractaires au traitement médical, comme des hémorragies digestives liées à l’hypertension portale non contrôlées par un traitement endoscopique, ou en cas de cholangiopathie portale symptomatique (fig. 4). La recanalisation portale s’effectue par la pose d’un stent dans la veine porte ; elle peut être associée à la pose d’un TIPS (transjugular intrahepatic portosystemic shunt) L’abord peut être transhépatique, transsplénique ou transmésentérique. Cette procédure de radiologie interventionnelle est complexe et nécessite une prise en charge multidisciplinaire dans un centre expert, ce qui permet d’obtenir un succès technique de 80 % environ, mais au prix d’un taux de complications d’environ 20 %.21,22
Chez les malades atteints de cirrhose, la présence d’une TVP n’est généralement pas une contre-indication à la mise en place d’un TIPS, surtout lorsque la TVP est partielle (ce qui est le plus fréquent). Le TIPS est envisagé en cas de complications sévères de l’hypertension portale (hémorragie digestive récidivante ou réfractaire, ascite réfractaire). Il peut être également indiqué en cas de TVP progressive sous traitement anticoagulant, en particulier pour les patients candidats à la transplantation hépatique.20
Un traitement endoscopique (cholangio-pancréatographie rétrograde endoscopique [CPRE]) n’est proposé qu’en cas de cholangiopathie portale symptomatique (angiocholite, pancréatite, ictère ou prurit), en raison de la difficulté du geste dans le contexte et du fait du sur-risque hémorragique. Il permet l’extraction des calculs biliaires ou la pose d’une endoprothèse biliaire pour le traitement des sténoses.
Complication grave : l’ischémie mésentérique veineuse
L’ischémie mésentérique est la complication aiguë la plus redoutée de la TVP. Elle survient généralement lorsqu’il existe une extension du thrombus à la veine mésentérique supérieure et aux arcades veineuses mésentériques, entraînant un défaut de drainage du flux sanguin intestinal avec congestion hémorragique tissulaire, conduisant à une ischémie, voire à un infarctus hémorragique. La thrombose de la veine mésentérique supérieure représente environ 15 % des ischémies mésentériques aiguës (la majorité étant d’origine artérielle). Elle se complique d’une ischémie mésentérique dans environ 20 à 40 % des cas.
L’ischémie mésentérique est une urgence médico-chirurgicale, avec un risque de résection intestinale d’environ 35 % et une mortalité entre 10 et 30 %.3,23 Il s’agit d’une complication rare lorsque la TVP survient dans un contexte de cirrhose.6 La présentation clinique est superposable à celle de la thrombose portomésentérique aiguë (douleur abdominale, syndrome inflammatoire) et n’est pas spécifique. La persistance ou l’aggravation de la douleur malgré le traitement anticoagulant, l’apparition d’un iléus ou d’une hémorragie digestive doivent faire évoquer l’évolution vers une ischémie mésentérique, même si elle n’était pas présente sur l’imagerie initiale.23
Une ischémie mésentérique est recherchée systématiquement sur le scanner abdominal aux quatre temps (sans injection, temps artériel, portal et tardif) et est confirmée par la constatation de signes de souffrance intestinale associés à la TVP tels qu’un épaississement de la paroi intestinale et/ou une diminution de rehaussement des anses après injection de produit de de contraste. La mise en évidence d’une absence de rehaussement pariétal, d’une dilatation intestinale supérieure à 25 mm ou encore d’une pneumatose intestinale voire aéroportie (présence de gaz dans la lumière de la veine porte) sont des signes de gravité évoquant une nécrose intestinale et indiquant un traitement chirurgical.
La prise en charge de l’ischémie mésentérique est complexe. Elle nécessite l’intervention d’une équipe multidisciplinaire, au mieux coordonnée avec un centre expert. Le réseau SURVI (Structure d’URgences Vasculaires Intestinales) est dédié à la prise en charge des ischémies mésentériques (https ://www.survi.fr/). Cette prise en charge multiparamétrique a permis d’améliorer le pronostic des malades ayant une ischémie mésentérique (fig. 5).24
Le traitement médical comporte un traitement anticoagulant à dose curative et l’arrêt de l’alimentation orale. Un traitement empirique par inhibiteur de la pompe à protons et une décontamination digestive par antibiotiques (gentamicine 80 mg/j et métronidazole 1,5 g/j) sont fréquemment proposés car ils ont été associés à une diminution du risque de nécrose intestinale dans des études observationnelles.25 Une exploration chirurgicale doit être réalisée en urgence en cas de suspicion de nécrose intestinale (défaillance d’organe, hyperlactatémie, signes radiologiques de nécrose tels qu’une dilatation ou une absence de rehaussement pariétal). En cas de nécrose intestinale, une résection chirurgicale du segment atteint doit être effectuée, avec réalisation d’une stomie.
2. Nery F, Chevret S, Condat B, et al. Causes and consequences of portal vein thrombosis in 1,243 patients with cirrhosis: Results of a longitudinal study, Hepatology 2015;61(2):660-7.
3. A. Plessier A, Darwish-Murad S, Hernandez-Guerra M, et al. Acute portal vein thrombosis unrelated to cirrhosis: A prospective multicenter follow-up study. Hepatology 2010;51(1):210‑8.
4. Elkrief L, Hernandez-Gea V, Senzolo M, et al. Portal vein thrombosis: Diagnosis, management, and endpoints for future clinical studies. Lancet Gastroenterol Hepatol 2024;9(9):859‑83.
5. Noronha Ferreira C, Seijo S, Plessier A, et al. Natural history and management of esophagogastric varices in chronic noncirrhotic, nontumoral portal vein thrombosis. Hepatology 2016;63(5):1640-50.
6. Amitrano L, Guardascione MA, Brancaccio V, et al. Risk factors and clinical presentation of portal vein thrombosis in patients with liver cirrhosis. J Hepatol 2004; 40(5):736‑41.
7. De Franchis R, Bosch J, Garcia-Tsao G, et al.Baveno VII – Renewing consensus in portal hypertension. J Hepatol 2022;76(4):959‑74.
8. Ollivier-Hourmand I, Lebedel L, Bartroli Alabau B, et al. Recurrent splanchnic and extrasplanchnic thrombotic events in patients with non-cirrhotic portal vein thrombosis associated with local factors. J Hepatology 2024;81(3):451‑60.
9. Plessier A, Rautou PE, Valla DC. Management of hepatic vascular diseases. J Hepatol 2012;56 Suppl 1:S25‑S38.
10. Valeriani E, Di Nisio M, Riva N, et al. Anticoagulant therapy for splanchnic vein thrombosis: A systematic review and meta-analysis. Blood 2021;137(9):1233‑40.
11. Rautou PE, Caldwell SH, Villa E. Bleeding and thrombotic complications in patients with cirrhosis: A state-of-the-art appraisal. Clin Gastroenterol Hepatol 2023;21(8):2110‑23.
12. Plessier A, Goria O, Cervoni JP, et al. Rivaroxaban prophylaxis in noncirrhotic portal vein thrombosis. NEJM Evid 2022;1(12):EVIDoa2200104.
13. Englesbe MJ, Schaubel DE, Cai S, et al. Portal vein thrombosis and liver transplant survival benefit. Liver Transpl 2010;16(8):999‑1005.
14. Loffredo L, Pastori D, Farcomeni A, et al. Effects of anticoagulants in patients with cirrhosis and portal vein thrombosis: A systematic review and meta-analysis. Gastroenterology 2017;153(2):480-7.
15. Guerrero A, del Campo L, Piscaglia F, et al. Anticoagulation improves survival in patients with cirrhosis and portal vein thrombosis: The IMPORTAL competing-risk meta-analysis. J Hepatol 2023;79(1):69‑78.
16. Simon TG, Singer DE, Zhang Y, et al. Comparative effectiveness and safety of apixaban, rivaroxaban, and warfarin in patients with cirrhosis and atrial fibrillation. Ann Intern Med 2024;177(8):1028‑38.
17. Riescher-Tuczkiewicz A, Elkrief L, Rautou PE. Thromboses veineuses splanchniques. Rev Med Interne 2024;45(1):17-25.
18. Turco L, de Raucourt E, Valla D, et al. Anticoagulation in the cirrhotic patient. JHEP Rep 2019;1(3):227‑39.
19. Guillaume M, Christol C, Plessier A, et al. Bleeding risk of variceal band ligation in extrahepatic portal vein obstruction is not increased by oral anticoagulation. Eur J Gastroenterol Hepatol 2018;30(5):563-8.
20. Bureau C, Larrue H. Recommandations TIPS : indications et modalités. Recommandations de l’AFEF 2023.
21. Artru F, Vietti-Violi N, Sempoux C, et al. Portal vein recanalisation alone to treat severe portal hypertension in non-cirrhotic patients with chronic extrahepatic portal vein obstruction. JHEP Rep 2022;4(8):100511.
22. Marot A, Barbosa JV, Duran R, et al. Percutaneous portal vein recanalization using self-expandable nitinol stents in patients with non-cirrhotic non-tumoral portal vein occlusion. Diagn Interv Imaging 2019;100(3):147‑56.
23. Nuzzo A, Maggiori L, Ronot M, et al. Predictive factors of intestinal necrosis in acute mesenteric ischemia: Prospective study from an intestinal stroke center. Am J Gastroenterol 2017;112(4):597-605.
24. A. Roussel A, Castier Y, Nuzzo A, et al. Revascularization of acute mesenteric ischemia after creation of a dedicated multidisciplinary center. J Vasc Surg 2015;62(5):1251‑6.
25. Nuzzo A, Maggiori L, Paugam-Burtz C, et al. Oral antibiotics reduce intestinal necrosis in acute mesenteric ischemia: A prospective cohort study. American J Gastroenterol 2019;114(2):348-51.