Deux antiépileptiques – le valproate de sodium et le topiramate – sont à éviter absolument pendant la grossesse car les enfants exposés in utero ont un risque très augmenté de troubles neurodéveloppementaux et de malformations. Pour éviter que des grossesses soient exposées à ces médicaments, il ne suffit pas de le proscrire pendant la grossesse. En effet quand une femme épileptique, bipolaire ou migraineuse traitée par l’un de ces médicaments s’aperçoit qu’elle est enceinte, il est trop tard pour éviter l’exposition au début de sa grossesse.
Valproate de sodium
La tératogénicité du valproate est connue depuis les années 1980, mais plus de 1 000 grossesses étaient encore exposées à ce médicament chaque année jusqu’en 2013. Des alertes ont été lancées depuis 2015 limitant chez les femmes épileptiques successivement les initiations de prescription (juin 2015) puis leur renouvellement (31 décembre 2015), et chez les femmes bipolaires les initiations de prescription et le renouvellement (juillet 2018). La recommandation officielle est « Ne pas prescrire de valproate chez les filles, les adolescentes, les femmes en âge de procréer et les femmes enceintes, sauf en cas d’inefficacité ou d’intolérance aux alternatives médicamenteuses ». Et, depuis 2017, un pictogramme figure sur chaque boîte avec la mention « VALPROATE + GROSSESSE = INTERDIT. Ne pas utiliser chez les femmes en âge de procréer et sans contraception efficace, ou enceintes » (fig. 1).
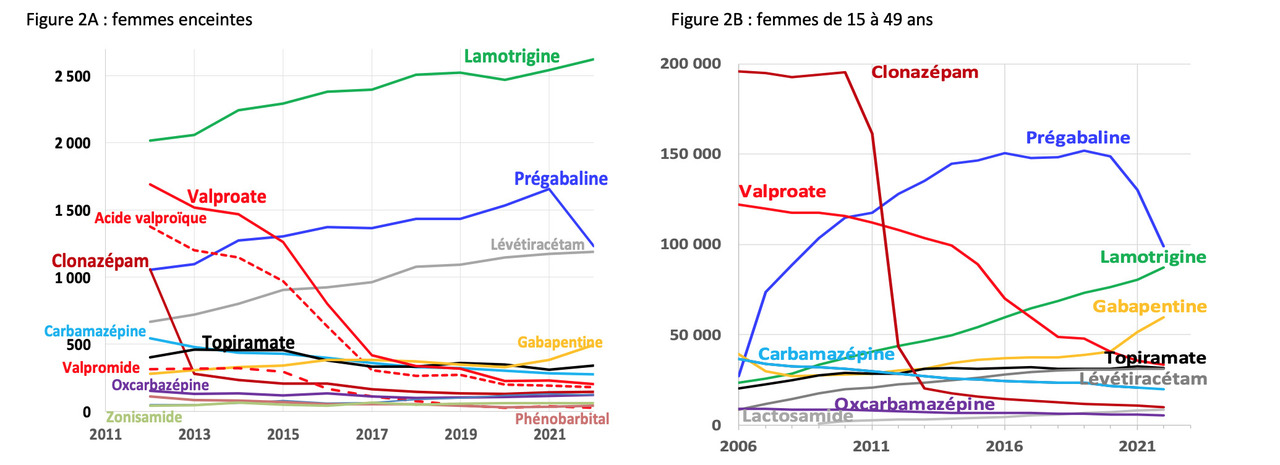
Malgré ces recommandations et une nette diminution des prescriptions (fig. 2), plus de 200 grossesses ont été exposées au valproate de sodium en 2022 (les données de 2023 ne sont pas encore disponibles), et le médicament a été prescrit à 33 000 femmes de 15 à 49 ans, dont plus de 7 000 initiations du traitement. Ceci laisse planer un doute sur la façon dont ces recommandations sont appliquées par les prescripteurs.
Topiramate
Le topiramate ne peut « plus être employé dans le traitement de l’épilepsie chez les filles, adolescentes, femmes en âge de procréer n’utilisant pas de méthodes de contraception efficace, et chez les femmes enceintes sauf exceptionnellement en cas d’absence d’alternative thérapeutique et seulement après une information de la patiente ». Ceci s’applique depuis le 2 novembre 2022 pour les initiations de traitement et depuis le 2 mai 20231 pour les patientes en cours de traitement.
En 2022, donc essentiellement avant les recommandations, on a observé en France 340 grossesses et 31 000 femmes de 15 à 49 ans exposées au topiramate.
Autres antiépileptiques
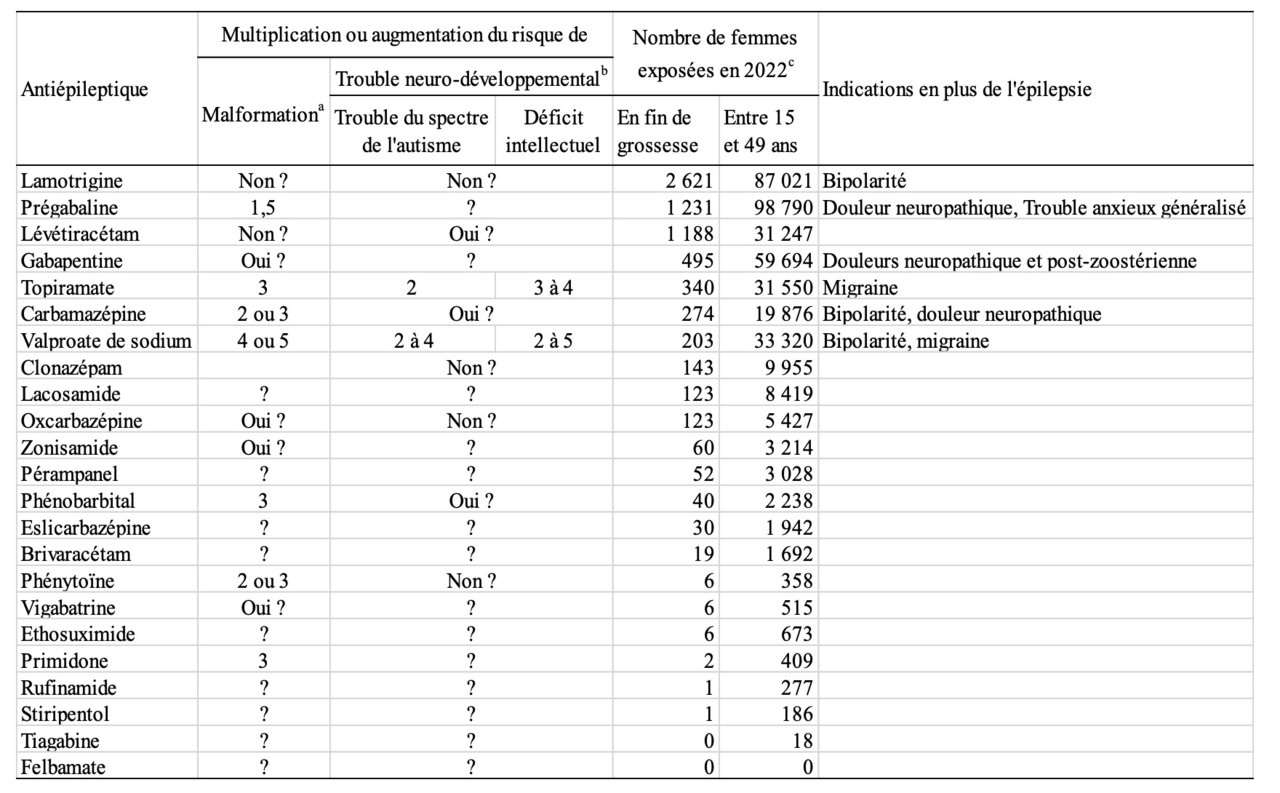
D’autres antiépileptiques augmentent aussi ces risques, mais à un niveau moindre. L’exposition in utero au phénobarbital, à la primidone, à la carbamazépine, à la phénytoïne et à la prégabaline augmente le risque de malformation. Et l’exposition in utero à la carbamazépine augmente le risque de trouble neurodéveloppemental. Le tableau 1 résume les données disponibles sur les différents antiépileptiques et les risques auxquels ils exposent s’ils sont utilisés pendant la grossesse. Pour beaucoup d’antiépileptiques, trop récents ou peu utilisés, les informations manquent. Par ailleurs, l’usage de la prégabaline est détourné à des fins toxicomaniaques, et la figure 2 ne présente que les données de remboursement, sans tenir compte du marché noir.
Encore trop d’enfants concernés
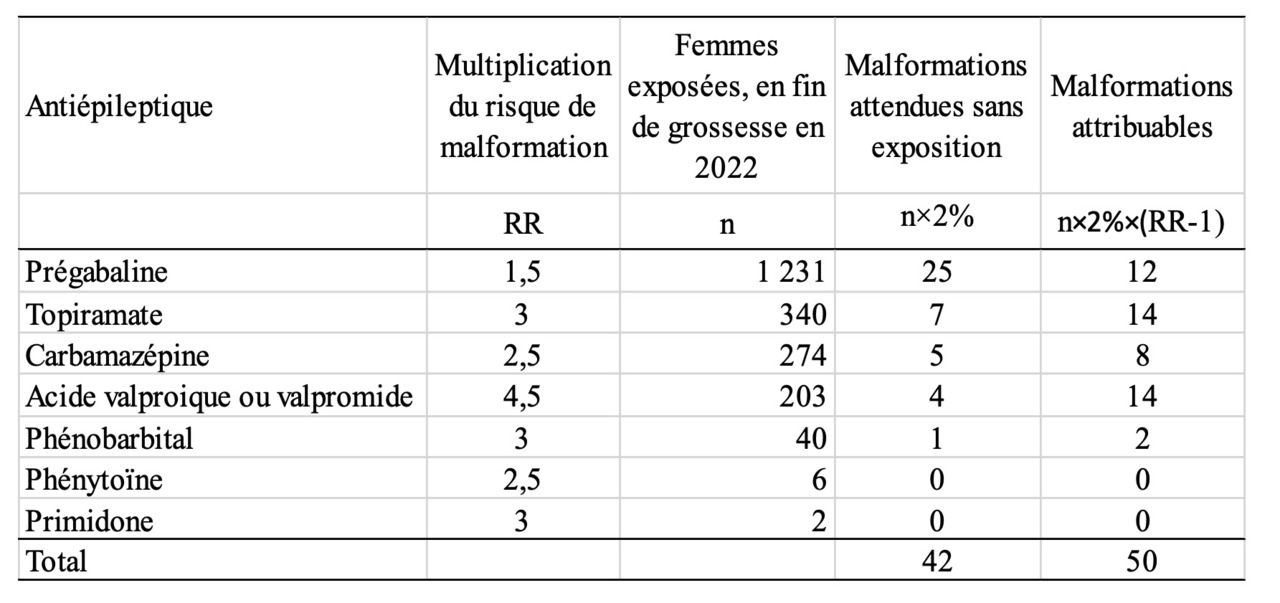
Le tableau 2 présente les estimations du nombre de malformations attribuables aux différents antiépileptiques pour lesquels on dispose d’une estimation du risque relatif de malformations (rapport des risques dans la population exposée et dans la population non exposée). Ces dernières sont imprécises mais donnent des indications sur les ordres de grandeur. La prégabaline est la première cause de malformations chez les enfants exposés à un antiépileptique en 2022, et ceci reste vrai si on suppose que le risque est multiplié seulement par 1,25 au lieu de 1,5. Si ces femmes n’avaient pas été exposées à ces antiépileptiques, on se serait attendu à observer 42 enfants avec une malformation, mais à cause de leur exposition on attend 50 enfants de plus avec une malformation, donc un total de 92 enfants.
Ainsi, malgré des alertes successives, trop de grossesses sont aujourd’hui exposées à des antiépileptiques dont la toxicité in utero est avérée ou fortement suspectée.
Erreurs d’interprétation
Pourtant, nombreuses sont les études qui ont comparé la fréquence des malformations ou des troubles neurodéveloppementaux chez les enfants exposés in utero aux différents antiépileptiques et chez les enfants de la population générale ou de femmes épileptiques ne prenant pas d’antiépileptique2 - 7. Bien que très convaincants, les résultats de ces études ont été discrédités pour deux raisons.
La première critique portait sur la nature observationnelle des enquêtes. Cependant, dans le contexte du traitement de l’épilepsie, exiger des essais randomisés est abusif : la grossesse est un critère de non-inclusion dans pratiquement tous les essais thérapeutiques, et il faudrait inclure des milliers de femmes épileptiques, bipolaires et migraineuses en âge de procréer dans des essais comparant deux médicaments pour pouvoir comparer leur toxicité in utero.
La seconde critique portait sur la nature rétrospective de beaucoup d’enquêtes. On peut suivre prospectivement une population de femmes épileptiques, bipolaires ou migraineuses, et comparer l’état de leur(s) enfant(s) en fonction des médicaments pris pendant leur(s) grossesse(s), mais ceci peut se faire quasiment aussi bien de façon rétrospective.
Un risque aussi en cas d’exposition des pères ?
Une alerte en ce sens a été donnée par l’ANSM en mai8 et août 20239 à la suite d’une étude menée dans trois pays nordiques (Danemark, Norvège et Suède). Les résultats de cette étude sont disponibles sur le site de l’EMA depuis le 17 mai 2024, sous la forme de trois rapports10 - 12, mais regrettablement, il n’y a aucune publication dans une revue à comité de lecture.
Cet essai a comparé le risque de trouble neurodéveloppemental et le risque de malformation chez les enfants dont les pères ont pris du valproate de sodium en monothérapie dans les 3 mois avant la conception au même risque chez les enfants dont les pères ont pris de la lamotrigine ou du lévétiracétam (traitement contrôle). Les enfants ont été suivis jusqu’à l’âge de 12 ans. Dans chacun des trois pays, les deux populations comparées – pères prenant du valproate et pères prenant de la lamotrigine ou du lévétiracétam – avaient des caractéristiques différentes. Les risques de trouble neurodéveloppemental et de malformation ont donc été comparés entre les deux groupes traités en ajustant sur un score de propension spécifique à chaque pays. Ce score de propension est un résumé des facteurs de confusion (caractéristiques qui sont différentes dans les deux populations et qui modifient le risque de trouble neurodéveloppemental ou de malformation). Le rapport des risques ainsi ajusté et égal à 1,50, avec un intervalle de confiance (1,09 - 2,07) et un p égal à 0,0138. On a donc moins de 1,38 chances sur 100 d’observer une différence aussi importante simplement par effet aléatoire, la différence est donc statistiquement significative au seuil conventionnel de 5 % (1,38 % < 5 %). Le risque de trouble neurodéveloppemental est augmenté de 50 % chez les enfants dont les pères ont pris du valproate de sodium en monothérapie dans les 3 mois avant la conception, par rapport aux enfants du groupe contrôle, mais aucune augmentation du risque de malformation n’a été observée.
Mais une étude sur les données danoises (Christensen et al.13) n’a pas confirmé cette alerte. Les auteurs ont comparé les risques chez les 1 336 enfants des pères prenant du valproate aux enfants de la population générale au Danemark entre 1997 et 2017, et ne trouvent pas d’augmentation des risques de malformation, de trouble neurodéveloppemental ni d’autisme.
On a donc deux analyses des mêmes données danoises à peu près dans la même période (1997 - 2018 dans l’étude ayant conduit à l’alerte et 1997 - 2017 dans l’étude de Christensen et al.) avec des nombres d’enfants exposés très différents (793 et 1 336 respectivement) et des résultats contradictoires.
Enfin, une publication14 qui a résumé les données publiées (donc sans prendre en compte l’étude à l’origine de l’alerte) a conclu qu’il n’y avait pas de signal.
2. Perucca P, Battino D, Bromley R, et al. Epilepsy-pregnancy registries: An update. Epilepsia 2025;66(1):47-59.
3. Bromley R, Adab N, Bluett-Duncan M, et al. Monotherapy treatment of epilepsy in pregnancy: congenital malformation outcomes in the child. Cochrane Database Syst Rev 2023;8(8):CD010224.
4. ANSM. Antiépileptiques au cours de la grossesse. État actuel des connaissances sur le risque de malformations et de troubles neurodéveloppementaux. Synthèse. Novembre 2023.
5. Beau AB, Mo J, Moisset X, et al. Systematic review of gabapentinoid use during pregnancy and its impact on pregnancy and childhood outcomes: A ConcePTION study. Therapie 2024;S0040-5957(24)00165-3.
6. Madley-Dowd P, Ahlqvist VH, Forbes H, et al. Antiseizure medication use during pregnancy and children’s neurodevelopmental outcomes. Nat Commun 2024;15(1):9640.
7. Dreier JW, Bjørk MH, Alvestad S, et al. Prenatal Exposure to Antiseizure Medication and Incidence of Childhood- and Adolescence-Onset Psychiatric Disorders. JAMA Neurol 2023;80(6):568-77.
8. ANSM. Évaluation européenne du risque potentiel de troubles neurodéveloppementaux chez les enfants dont le père a été traité par valproate dans les mois précédant la conception. 16 août 2023
9. ANSM. Valproate et dérivés : risque potentiel de troubles neurodéveloppementaux chez les enfants dont le père a été traité dans les 3 mois qui précèdent la conception. 16 novembre 2023.
10. EMA. Post-authorisation safety study (PASS) protocol. A post-authorisation safety study (PASS) to evaluate the paternal exposure to valproate and the risk of neurodevelopmental disorders including autism spectrum disorder as well as congenital abnormalities in offspring – a population-based retrospective study. 2 octobre 2023.
11. EMA. Valproate EU consortium. A post-authorisation safety study (PASS) to evaluate the paternal exposure to valproate and the risk of neurodevelopmental disorders including autism spectrum disorder as well as congenital abnormalities in offspring – a population-based retrospective study. 2 octobre 2023.
12. EMA. Outcomes of imposed non-interventional post-authorisation safety studies. 17 mai 2024.
13. Christensen J, Trabjerg BB, Dreier JW. Valproate Use During Spermatogenesis and Risk to Offspring. JAMA Netw Open 2024;7(6):e2414709.
14. Honybun E, Rayner G, Malpas CB, et al. Paternal exposure to antiseizure medications and offspring outcomes: a systematic review. J Neurol Neurosurg Psychiatry 2024;96(1):15-25.
Pour en savoir plus :
Dupont S. Épilepsie de l’adulte : les 10 messages clés. Rev Prat 2024;74(9):1001.