Le radical « -odynies » vient du grec ancien « odynos » qui signifie « la douleur ».
Étymologiquement, vulvodynie signifie donc « vulve douloureuse ».
Cependant, cette terminologie est consensuellement réservée à la douleur chronique (Consensus sur la terminologie et la classification des douleurs vulvaires, ISSVD, 2003).1
La douleur chronique est définie comme une douleur qui dure ou réapparaît pendant plus de trois mois. C’est une pathologie à part entière et elle fait partie, depuis 2019, de la liste des maladies de la nouvelle Classification internationale (CIM- 11).
La dernière mise à jour de la définition de la douleur par l’International Association for the Study of Pain (IASP) évoque « une expérience sensorielle et émotionnelle désagréable associée à, ou ressemblant à, celle associée à une lésion tissulaire réelle ou potentielle ».
Cette formulation explique l’incompréhension habituelle dans laquelle se trouvent les patientes – et bien souvent leur praticien – devant l’existence de douleurs chroniques dans une zone ne comprenant pas (ou peu) de dommage tissulaire. La prise en charge de cette pathologie nécessite donc un changement de paradigme par rapport au modèle anatomoclinique classique dans lequel l’intensité de la douleur est censée être proportionnelle à l’importance des lésions tissulaires.
Lorsque l’on évoque le diagnostic de vulvodynie, toutes les lésions vulvaires ont déjà été écartées, qu’elles soient d’origine infectieuse, traumatique, cicatricielle, malformative ou néoplasique.
On distingue les vulvodynies « provoquées », dont la forme la plus fréquente est la vestibulodynie provoquée (VDP) et les vulvodynies « spontanées » dont le modèle est la douleur neuropathique vulvaire de la névralgie pudendale (NP).
Si cette distinction apparaît utile pour différencier ces deux grands syndromes de douleurs pelvi-périnéales chroniques (DPPC), la physiopathologie des vulvodynies apparaît bien plus complexe.
Vestibulodynies vulvaires provoquées
Plus fréquente des vulvodynies provoquées, la douleur vulvaire située en regard du vestibule, dite vestibulodynie vulvaire provoquée (VDP), est essentiellement déclenchée par le contact, le rapport sexuel, l’examen gynécologique, l’introduction du tampon, sans aucune lésion vulvaire spécifique à l’examen clinique.
La plainte principale est la dyspareunie d’intromission, dite orificielle.
La douleur est déclenchée par le contact du coton-tige sur le vestibule vulvaire (Q-tip test) lors de l’examen clinique.
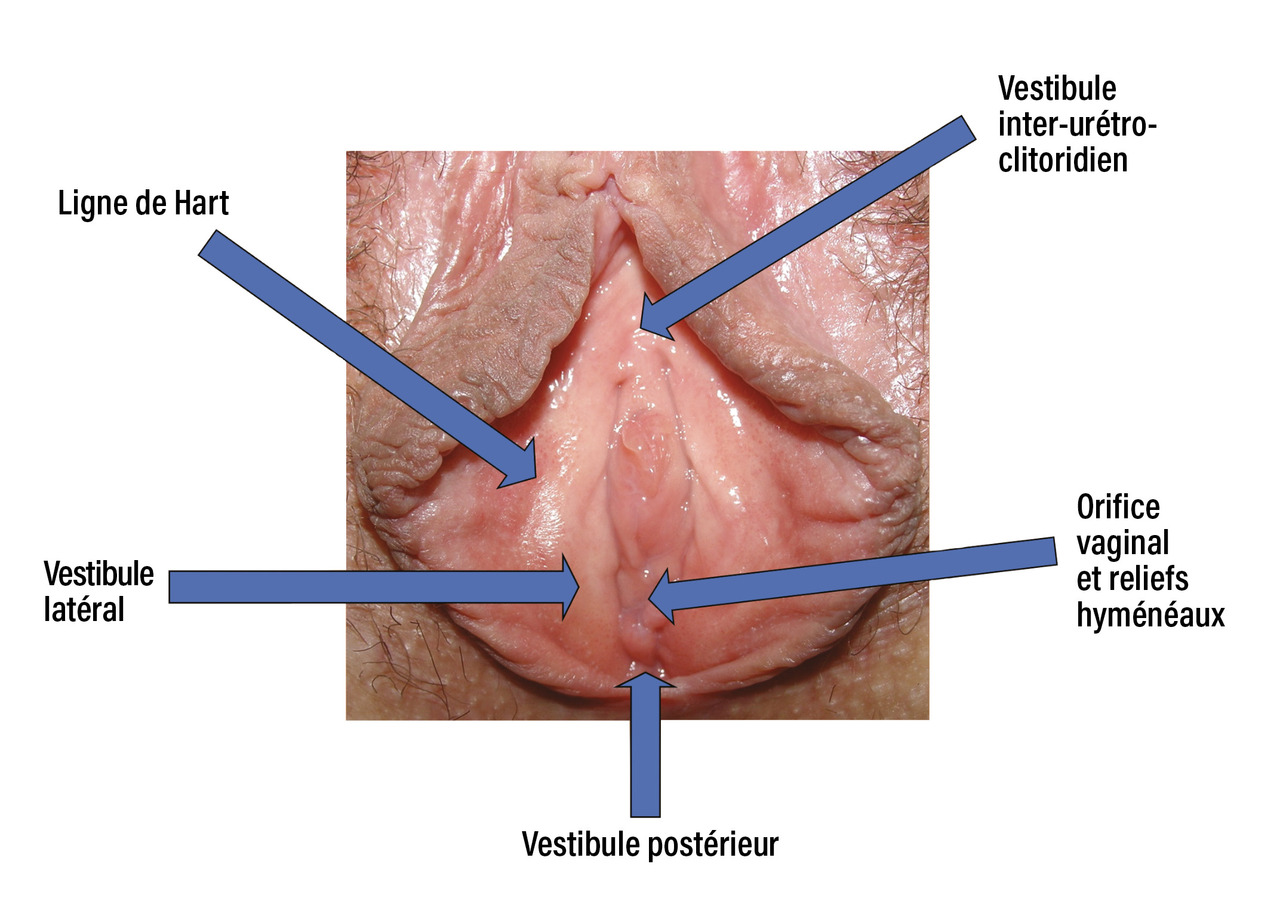
Le vestibule vulvaire est une entité anatomique dont les limites sont représentées sur la figure : la ligne de Hart située latéralement et en dehors, l’orifice vaginal dont l’entrée est marquée par l’hymen en dedans, le vestibule postérieur, le vestibule latéral et le vestibule inter-urétroclitoridien. Le vestibule vulvaire est une entité spécifique, avec sa particularité embryologique (issue du sinus uro-génital) et histologique (lui conférant une forte richesse en terminaisons nerveuses).
Épidémiologie en Europe
L’analyse des différents registres européens par la CIM- 10 (code N 76.3 de la Classification internationale des maladies), les registres nationaux, les importantes études épidémiologiques et enquêtes auprès des gynécologues des pays européens permettent de dresser un profil épidémiologique européen de la VDP : 2,3
le registre italien Progetto Vu-NET confirme qu’elle représente 72,6 % de l’ensemble des douleurs vulvaires. Elle touche les femmes de tous les âges, avec un pic de fréquence entre 20 et 29 ans (29 %) ;
la prévalence peut être évaluée entre 10 et 16 % des femmes.
Deux mécanismes physiopathologiques
L’ensemble des experts s’accorde pour reconnaître deux mécanismes physiopathologiques :
- l’intervention d’une entité anatomique, le vestibule vulvaire, particulièrement riche en terminaisons nerveuses, à la différence des autres tissus vulvaires ou du vagin ;
- des phénomènes d’hyperalgésie avec sensibilisation centrale et périphérique.
Cette sensibilisation du système nociceptif périphérique et central explique l’existence de douleurs chroniques dans des zones ne comprenant pas (ou peu) de dommage tissulaire.
Les phénomènes d’hyperalgésie s’associent à des modifications neuro-inflammatoires importantes du vestibule vulvaire avec activations mastocytaires adjacentes aux terminaisons nerveuses.4
La VDP s’associe de manière significative à une dysfonction périnéale comprenant une tendance hypertonique marquée, une diminution des mécanismes de flexibilité des capacités de relaxation musculaire et de la puissance musculaire comparativement aux groupes contrôle.5
L’association fréquente de comorbidités, comme le syndrome de la vessie douloureuse, le syndrome de l’intestin irritable, la dysménorrhée, peut être expliquée par l’aggravation des mécanismes d’hypersensibilisation pelvienne.6
La VDP peut également constituer l’un des symptômes de l’hypersensibilisation pelvienne centrale (HPC).7
Les causes de cette hyperalgésie du vestibule vulvaire sont nombreuses et rencontrées tout au long de la vie : infections répétées de la femme jeune (Candida, Papillomavirus humain [HPV]), traumatismes de l’accouchement, modifications hormonales sévères de la ménopause, conséquences de pathologies vulvaires comme le lichen scléro-atrophique en post-ménopause. À ces causes d’hyperalgésie locale s’ajoutent les modifications des seuils de la sensibilisation centrale pouvant être induites par les troubles affectifs, relationnels ou les traumatismes sexuels.
Recommandations pour le traitement de première ligne
Des recommandations ont été publiées en 2019, à l’issue d’un consensus organisé par Convergences PP, société scientifique européenne dédiée aux DPPC.3
La première ligne de traitement découle des mécanismes physiopathologiques. Elle prend en compte les phénomènes d’hypersensibilisation, l’hyperalgésie du vestibule vulvaire et la dysfonction périnéale, selon une prise en charge multimodale en trois axes.
Traitement de l’hyperalgésie locale du vestibule vulvaire par application biquotidienne au long cours d’anesthésiques locaux (lidocaïne 2 à 10 %). Le traitement local est utilisable également avant le rapport sexuel.
Le traitement de l’hyperalgésie locale peut associer un traitement de la sensibilisation pelvienne par voie orale : amitriptyline en première intention, puis prégabaline ou gabapentine ou duloxétine, notamment en cas de comorbidités.
Rééducation périnéologique (périnéale et globale) externe et progressivement manuelle endocavitaire en relâchement musculaire, biofeedback négatif, technique de rétablissement de la fonction périnéale. Les objectifs sont le traitement global de l’hypertonie périnéale, essentiellement en relâchement des muscles du périnée superficiel mais aussi du périnée profond (muscles élévateurs de l’anus et obturateurs internes), la réappropriation du schéma corporel et la rééducation des dysynergies vésicales et rectosphinctériennes.
Thérapeutiques cognitivo-comportementales comprenant la psychothérapie cognitive, les thérapies psychosexuelles et, en cas de traumatisme, les thérapies centrales type EMDR (eye movement desensitization and reprocessing) ou l’hypnose.
Le protocole thérapeutique initial, ici résumé, bénéficie, outre le consensus d’experts, d’un fort niveau de preuve d’efficacité, avec des niveaux de grade A et B, retrouvés dans la littérature pour chacun des trois items.
Thérapeutiques de seconde intention
En cas d’échec du protocole thérapeutique de première ligne, de nombreuses options thérapeutiques ont été décrites, sans pouvoir confirmer leur intérêt véritable ni leur indication précise, au vu des données de la littérature.
Ces techniques demeurent donc, à ce jour, toujours en cours de validation et restent du domaine des centres d’expertise.
Les infiltrations vestibulaires vulvaires n’ont fait aucune preuve d’efficacité dans le traitement de la VDP, que ce soit avec anesthésiques locaux, corticoïdes ou acide hyaluronique. Les infiltrations ont, de plus, l’inconvénient important d’être particulièrement douloureuses sur une zone vestibulaire hyperalgésique.
Les autres topiques, à base de gabapentine, d’amitriptyline, de kétamine, de toxine botulinique, sont en cours d’évaluation.
Les injections de toxine botulinique ont fait l’objet de plusieurs publications faisant état d’une efficacité thérapeutique au niveau du vestibule vulvaire, avec un niveau de preuve de grade C. Les résultats apparaissent cependant inconstants et à la limite de la significativité. En revanche, l’efficacité de la toxine botulinique est bien établie en cas d’hypertonie périnéale sévère résistante à la rééducation. Elle trouve là une bonne indication dans le protocole thérapeutique en injection dans les muscles du périnée hypertoniques.
La stimulation nerveuse transcutanée électrique (TENS) du vestibule vulvaire apparaît efficace dans le traitement de la VDP, avec des niveaux de preuve de grade B. Son intérêt a été confirmé par plusieurs équipes, qui la positionnent en thérapeutique de seconde ligne avant la chirurgie de vestibulectomie.
Le laser CO2 est une technique récente et prometteuse, en particulier en post-ménopause, en association avec le traitement du syndrome urogénital de la ménopause. Cependant, les études récentes ne confirment pas d’efficacité significative dans le traitement de la VDP.
La TECARthérapie (transfert energy capacitif and resistif) et la photothérapie par lumière Led sont simples d’utilisation et bénéficient d’un véritable engouement. Ces techniques ont été testées dans le traitement de la VDP, mais sans efficacité significative prouvée à ce jour.
Le lipofilling est une technique récemment utilisée ; il s’agit d’utiliser les facteurs de croissance de la graisse dans le traitement des cicatrices douloureuses du périnée. Les résultats sont prometteurs en traitement de deuxième ligne de la VDP, notamment en cas de lésions tissulaires, fissuraires. Des évaluations sont en cours.
L’infiltration du ganglion impar est une option thérapeutique récemment proposée dans le traitement des VDP rebelles. Cette méthode est également en cours d’évaluation.
La vestibulectomie peut se faire par plusieurs techniques : vestibulectomie postérieure simple pouvant s’associer à la vestibulectomie des vestibules latéraux, vestibulectomie totale incluant le vestibule péri-urétral, voire le vestibule inter-clitorido-urétral.
La vulvoplastie utilise le plus souvent la paroi vaginale, après la mobilisation d’un lambeau vaginal, afin de combler la perte de substance. La vestibulectomie représente, parmi les options thérapeutiques de seconde ligne, la technique qui bénéficie du plus grand nombre de publications dans la littérature et depuis le plus grand nombre d’années, avec un grade B de niveau de preuve et incontestablement un grand nombre de guérisons.15,17 Elle est donc largement utilisée par les centres d’expertise, notamment nord-américains.8 Cette option, de type chirurgical, avec un taux de complications postopératoires non négligeable (hématomes et reprises pour désunion), devrait néanmoins être maintenue en deuxième ligne thérapeutique.
Névralgies pudendales
Les névralgies pudendales (NP) font partie des douleurs neuropathiques périphériques chroniques de la classification de l’IASP pour la nouvelle CIM- 11. Elles sont détaillées dans l’article « Névralgies pudendales » page 392.
La douleur vulvaire est, dans les NP, spontanée, plutôt unilatérale et le plus souvent aggravée par la position assise. Le contact du vestibule vulvaire n’est pas douloureux. Les rapports sexuels sont possibles et rarement douloureux. Mais la libido est affectée par la douleur chronique.
Vulvodynies des syndromes myofasciaux des muscles du périnée
Les syndromes myofasciaux (SMF) sont définis par une douleur de type musculaire décrite comme une sensation de tension, pression, étau, spasme et associée à un point gâchette à la palpation d’un chef musculaire.9 La douleur de type musculaire et le point gâchette à la palpation sont très souvent associés à la rétraction des fibres musculaires, responsable d’une fréquente corde musculaire tendue, voire d’une franche hypertonie.
Les vulvodynies d’origine myofasciale prennent donc des caractéristiques de type musculaire, avec sensation de tension, pression vulvo-vaginale, voire périnéale (douleur référée). Elles peuvent être unilatérales mais sont le plus souvent bilatérales.
Elles s’accompagnent de dyspareunies dites intermédiaires, en particulier en cas d’hypertonie.
Les muscles intéressés sont les muscles du périnée superficiel (muscles pubovaginaux et transverses) mais aussi les muscles du périnée profond, en particulier les faisceaux puborectaux du muscle élévateur de l’anus ou les faisceaux endopelviens des muscles obturateurs internes.
Le SMF et l’hypertonie des muscles du périnée s’associent très fréquemment à la VDP.
Mais, surtout, le SMF intègre presque systématiquement les phénomènes d’hypersensibilisation pelvienne centrale.7
Diagnostic
Le diagnostic est clinique, fondé sur le type myofascial de la douleur à l’interrogatoire et la palpation du point gâchette douloureux au toucher vaginal, ainsi que de l’éventuelle corde musculaire.
L’imagerie n’apporte pas d’argument pour le diagnostic. En cas de franche hypertonie musculaire, l’imagerie par résonance magnétique (IRM) peut mettre en évidence des modifications à type d’épaississement du chef musculaire périnéal.
Un terrain anxieux, voire une notion de traumatisme affectif dans les antécédents récents, est fréquent, notamment dans les formes hypertoniques.
Traitements
L’amitriptyline par voie orale est le traitement médical de première intention. Par son action sur les mécanismes de sensibilisation centrale souvent observés dans le SMF, il est en effet plus intéressant que les benzodiazépines. Celles-ci sont trop souvent prescrites dans cette indication, alors même qu’elles s’avèrent peu efficaces et génératrices d’addictions délétères.
La rééducation pelvi-périnéale constitue le traitement fondamental du SMF. C’est bien sûr une rééducation opposée à celle utilisée habituellement après l’accouchement ou en traitement de l’incontinence ou du prolapsus. Il est donc nécessaire de bien préciser au praticien rééducateur l’objectif principal, qui est le relâchement musculaire. Cette rééducation est externe mais également endocavitaire. Elle peut utiliser les techniques de biofeedback, ici uniquement négatif.
Les sources de chaleur améliorent les douleurs myofasciales, à l’opposé des douleurs neuropathiques de la névralgie pudendale, qui sont plus volontiers améliorées par les applications de froid. L’application quotidienne de source de chaleur est donc conseillée ; elle est d’ailleurs souvent utilisée spontanément par les patientes.
Les techniques de TECARthérapie constituent un appoint très intéressant dans le SMF, notamment par l’induction des changements dans la température musculaire qu’elles induisent. Elles doivent être proposées en complément de la rééducation périnéale.
Le dry needling (ou « aiguilles sèches ») a été largement utilisé dans le traitement des points gâchettes du SMF. Les études randomisées et méta-analyses font état d’une efficacité modérée. Cette technique peut être intéressante en complément de la rééducation.
Les injections de toxine botulinique dans les muscles du périnée trouvent une indication dans le traitement du SMF, en particulier en cas d’hypertonie musculaire.10,11 La toxine botulinique a, d’une part, une efficacité reconnue et largement utilisée pour traiter l’hypertonie spastique et l’hypercontractilité et, d’autre part, des effets sur la douleur neuropathique périphérique et vraisemblablement les mécanismes de sensibilisation, périphériques et peut-être centraux.12
Une thérapie cognitivo-comportementale doit être mise en place, surtout en cas de personnalité anxieuse ou de traumatisme.
Vulvodynies spontanées de l’hypersensibilisation pelvienne centrale
Il s’agit de douleurs vulvaires spontanées pouvant être de type neuropathique, mais sans systématisation neurologique tronculaire. Elles sont souvent bilatérales, à type de brûlures et décharges électriques et débordant volontiers vers la fesse.
Il peut s’y associer de manière inconstante des douleurs myofasciales périnéales, des douleurs de contact avec hyperesthésie cutanée, une clitoridodynie, une vestibulodynie provoquée.
Diagnostic
La névralgie du nerf pudendal est facilement écartée devant l’étendue anatomique de la douleur et l’absence de systématisation. Cela permet d’éviter une inutile infiltration-test pudendale, qui serait non seulement négative mais surtout accompagnée d’une forte réponse en aggravation.
Les vulvodynies de l’hypersensibilisation pelvienne centrale (HPC) s’intègrent dans les critères de sensibilisation centrale de Convergences PP (se reporter à la figure Score Convergences PP de l’hypersensibilisation pelvienne centrale de l’article « Sensibilisation pelvienne » page 390).7
Les comorbidités associées sont très fréquentes, comme les syndromes douloureux viscéraux (syndrome de la vessie douloureuse, syndrome douloureux utérin, syndrome de l’intestin irritable).
Des dysfonctions sont également fréquemment associées, comme la dyschésie rectale ou la dysurie.
Traitements
Le traitement est difficile et ne peut s’envisager que dans le cadre de la multidisciplinarité.
Concernant les traitements médicamenteux, le protocole comprend l’introduction des traitements de la sensibilisation centrale, dérivés des antidépresseurs, comme l’amitriptyline ou bien un inhibiteur de la recapture de la sérotonine et de la noradrénaline, comme la duloxétine ou la venlafaxine, associés à des antalgiques de palier 2, comme le tramadol ou le néfopam. Les morphiniques sont contre-indiqués car ils aggravent les phénomènes d’hypersensibilisation.
La rééducation pelvienne et périnéale constitue un axe thérapeutique indispensable. En effet, comme indiqué plus haut, l’hypersensibilisation pelvienne centrale s’accompagne d’une tendance, quasi constante, à l’hypertonie musculaire, voire au SMF. Le travail de relâchement musculaire est donc fondamental. Il utilise les techniques de massage externe et parfois endocavitaire, ainsi que les sources de chaleur. Il favorise la réappropriation du schéma corporel et doit notamment s’attacher à rétablir les mécanismes des évacuations vésicale et rectale, toujours altérés.
Les injections de toxine botulinique pourraient logiquement être envisagées, notamment pour le traitement de la composante myofasciale et l’hypertonie musculaire très souvent associées dans la symptomatologie de l’HPC. Cependant, ces injections sont difficiles à envisager car elles sont mal tolérées dans cette situation de sensibilisation. En effet, elles s’avèrent plus douloureuses et entraînent parfois de sévères aggravations dans les jours qui suivent. Si l’indication est retenue, les injections doivent ainsi être réalisées sous sédation ou sous une courte anesthésie générale. La patiente peut alors bénéficier de traitement peropératoire de la sensibilisation centrale comme la kétamine ou le magnésium.
Les dispositifs TENS peuvent être proposés ainsi que les thérapies cognitivo-comportementales et de soutien.
Les perfusions de kétamine en sessions répétées sont largement utilisées.
Les techniques non agressives, comme la photobiomodulation, ainsi que l’adaptation nutritionnelle, peuvent également être proposées.
Les enseignements personnalisés (éducation thérapeutique de la patiente) sont, enfin, un appoint intéressant dans ce type de pathologie chronique.
Vulvodynies par sensibilisation périphérique
Les vulvodynies par sensibilisation périphérique (SP) font suite à des traumatismes locaux (interventions itératives compliquées, syndromes douloureux chroniques postopératoires, accouchements dystociques, etc.), cicatriciels le plus souvent (épisiotomie, chirurgies vulvaire, du kyste de la glande de Bartholin, du kyste sous-urétral, etc.). Elles peuvent être associées à un trouble de stress post-traumatique.
La composante neuropathique de la douleur peut faire évoquer une NP, mais la douleur au contact, voire la franche hyperalgésie, n’est pas en faveur d’une névralgie du nerf pudendal. La réponse au bloc anesthésique pudendal est négative.
Ces vulvodynies entrent dans le cadre des douleurs neuropathiques postopératoires et sont traitées comme telles. Le protocole thérapeutique comprend donc les gabapentinoïdes, les applications bi- ou tri-journalières d’anesthésiques locaux, les dispositifs TENS.
Malheureusement, dans cette localisation, la physiothérapie est difficile et souvent aggravante, car le contact est douloureux. Le travail, ou massage local, est en général plutôt contre-productif.
De même, les techniques agressives comme le laser sont à éviter.
Seule la photobiomodulation (Led), peu agressive, peut apporter un soulagement et s’avérer indiquée.
Les dispositifs à la capsaïcine ne sont pas utilisables dans cette localisation.
En revanche, les injections de toxine botulinique sont souvent efficaces.
Les thérapies cognitivo-comportementales, voire l’EMDR, trouvent ici une indication, car un contexte de traumatisme, voire de stress post-traumatique, est fréquent.
Clitoridodynies
Vulvodynies peu fréquentes, les clitoridodynies ont deux grandes causes :
- la névralgie du nerf pudendal, dans laquelle la douleur est spontanée et associée aux critères diagnostiques sus-cités. Le traitement est celui de la NP et du PNE en cas de critères de compression canalaire du nerf pudendal ;
- les phénomènes de sensibilisation centrale, avec notamment la clitoridodynie de contact, en particulier du vestibule sous-clitoridien. Le traitement est alors identique à celui de la VDP. Lorsque la clitoridodynie s’associe à des critères d’HPC, le traitement intègre le protocole multidisciplinaire de l’HPC.
Vulvodynies associées au syndrome d’excitation génitale persistante
Le syndrome d’excitation génitale persistante (SEGP) a été décrit pour la première fois en 2001 par Sandra Leiblum,13 sous la terminologie de « persistent sexual arousal syndrome » (PSAS), révisée en « persistent genital arousal disorder » (PGAD), par la même auteure en 2006.14
Il est défini comme une sensation d’excitation génitale continue ou intermittente, involontaire, spontanée, persistante et indépendante de toute situation de stimulation génitale ou sexuelle.
Le SEGP est très mal toléré et s’accompagne souvent d’une grande détresse psychologique, incluant une importante anxiété, dépression et tendance suicidaire.
Une modification de nomenclature a été proposée en 2021 par l’International Society for the Study of Women’s Sexual Health (ISSWSH),15 associant le terme de « genito-pelvic dysesthesia » (PGAD/GPD).
Les auteurs décrivent une importante activité de la région génitopelvienne, représentée dans le cortex somatosensoriel.
Certaines causes du SEGP pourraient donc être centrales, corticales et à rapprocher de mécanismes de sensibilisation centrale. Cependant, des mécanismes périphériques apparaissent possibles, liés à des atteintes neuropathiques tronculaires (nerf pudendal) mais aussi radiculaires ou médullaires.
L’association du SEGP avec une vulvodynie oriente fortement le diagnostic. Si celle-ci est une douleur neuropathique spontanée, dans le territoire d’une ou des branches du nerf pudendal, l’origine pudendale peut être évoquée. Les différents traitements de la neuropathie pudendale (infiltrations, neurolyse chirurgicale, neuromodulation) ont été rapportés dans la littérature, avec des taux d’amélioration, voire de guérison, significatifs.
Si la vulvodynie associée est de type hyperalgésie de contact, voire une VDP, l’orientation se fait vers un mécanisme de sensibilisation centrale. Les critères de l’HPC sont recherchés.7 Le SEGP peut alors être considéré comme l’un des symptômes de l’HPC.
Le traitement est celui de la vulvodynie de l’HPC. L’utilisation des injections de toxine botulinique périclitoridiennes a également donné des résultats intéressants.16
Savoir identifier les principaux syndromes cliniques
Le diagnostic et le traitement des vulvodynies impose une bonne connaissance des grands syndromes cliniques des douleurs pelvi-périnéales chroniques, en particulier de la vestibulodynie provoquée et de la névralgie pudendale.
Cependant, les vulvodynies ne se limitent pas à ces deux syndromes : la VDP peut également être l’un des symptômes d’une sensibilisation centrale, dont elle peut représenter une forme d’entrée. De même, une douleur neuropathique – y compris dans le territoire du nerf pudendal – peut faire partie des symptômes de l’hypersensibilisation pelvienne centrale.
2. Harlow BL, Stewart EG. A population-based assessment of chronic unexplained vulvar pain: Have we underestimated the prevalence of vulvodynia? J Am Med Women’s Assoc 2003;58:82-8.
3. Bautrant E, Porta O, Murina F, et al. Provoked vulvar vestibulodynia: Epidemiology in Europe, physio-pathology, consensus for a first-line treatment and evaluation of second-line treatments. J Gynecol Obstet Hum Reprod 2019;48:685-8.
4. Zanotta N, Campisciano G, Scrimin F, et al. Cytokine profiles of women with vulvodynia: Identification of a panel of pro-inflammatory molecular targets. Eur J Obstet Gynecol Reprod Biol 2018;226:66-70.
5. Naess I, Bo K. Pelvic floor muscle function in women with provoked vesibulodynia and asymptomatics controls. Int Urogynecol J 2015;26(10):1467-73.
6. Zhang Z, Zolnoun DA, Francisco EM, et al. Altered central sensitization in subgroups of women with vulvodynia. Clin J Pain 2011;27:755-63.
7. Levesque A, Riant T, Ploteau S, et al. Convergences PP Network. Cinical criteria of central sensitization in chronic pelvic and perineal pain (Convergences PP criteria): Elaboration of a clinical evaluation tool based on formal expert consensus. Pain Med 2018;19(10):2009-15.
8. Goldstein AT, Pukall CF, Brown G, et al. Vulvodynia: Assessment and treatment. J Sex Med 2016;13(4):572-90.
9. Giamberardino MA, Affaitati G, Fabrizio A, et al. Myofascial pain syndromes and their evaluation. Best pract Res Clin Rheumatol 2011;25(2):185-98.
10. Abbott JA, Jarvis SK, Lyons SD, et al. Botulinum toxin type A for chronic pain and pelvic floor spasm in women: A randomized controlled trial. Obstet Gynecol 2006;108(4):915-23.
11. Bautrant E, Quintas-Marques L, Eggermont J, et al. Use of botulinum toxin neurotoxin type A injections to the perineal muscles in cases of perineal pain and dysfunction associated with pelvic floor muscle overcontraction and myalgia. Toxicon 2015;93(Suppl):S7-S8.
12. Attal N, de Andrade DC, Adam F, et al. Safety and efficacy of repeated injections of botulinum toxin A in peripheral neuropathic pain (BOTNEP): A randomised, double-blind, placebo-controlled trial. Lancet Neurol 2016;15(6):555-65.
13. Leiblum S, Nathan SG. Persistent sexual arousal syndrome: A newly discovered pattern of female sexuality. J sex marital Ther 2001;27:365-80.
14. Leiblum S, Seehuus M, Goldmeier D, et al. Psychological, medical, and pharmacological correlates of persistent genital arousal disorder. J Sex Med 2007;4:1358-66.
15. Goldstein I, Komisaruk BR, Pukall CF, et al. International society for the study of women’s sexual health (ISSWSH) review od epidemiology and pathophysiology, and a consensus nomenclature and process care for the management of persistent genital arousal disorder/genito-pelvic dysesthesia (PGAD/GPD). J Sex Med 2021;18(4):665-97.
16. Rubin R, Winter AG, Minton JN, et al. Peri-clitoral botulinum toxin as a treatment for persistent genital arousal disorder (PGAD). J Sex Med 2017;14:e364.
Dans cet article
- Vestibulodynies vulvaires provoquées
- Névralgies pudendales
- Vulvodynies des syndromes myofasciaux des muscles du périnée
- Vulvodynies spontanées de l’hypersensibilisation pelvienne centrale
- Vulvodynies par sensibilisation périphérique
- Clitoridodynies
- Vulvodynies associées au syndrome d’excitation génitale persistante
- Savoir identifier les principaux syndromes cliniques