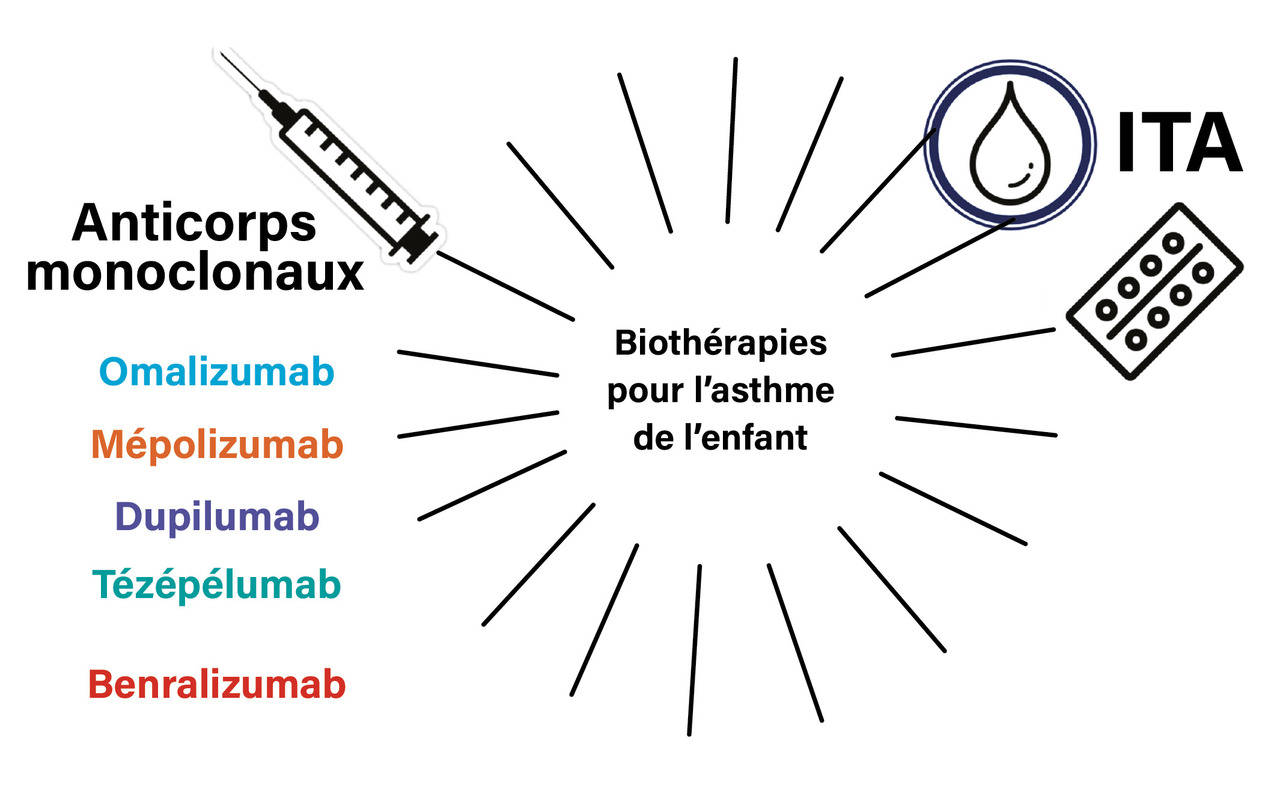
L’asthme sévère touche 0,5 % de la population pédiatrique générale et concerne 4,5 % des enfants asthmatiques. Les approches thérapeutiques ont évolué et, dans l’asthme sévère, ciblent désormais directement les acteurs de la cascade inflammatoire. Quatre biothérapies sont ainsi disponibles chez l’enfant : l’omalizumab, le mépolizumab, le dupilumab et le tézépélumab.
L’asthme est une maladie inflammatoire chronique touchant les voies aériennes inférieures, et l’asthme pédiatrique est l’une des affections chroniques les plus courantes chez l’enfant.1
L’asthme de l’enfant, exactement comme celui de l’adulte, se classe en intermittent ou persistant. L’asthme intermittent est caractérisé par des symptômes qui surviennent seulement à certaines périodes, et l’enfant n’a pas besoin d’un traitement de fond, mais exclusivement à la demande. Si les symptômes restent perceptibles entre deux crises, on parle d’asthme persistant, qui est qualifié de léger, modéré ou sévère. Le degré de sévérité est aujourd’hui défini par la charge thérapeutique nécessaire pour obtenir le contrôle des symptômes.
Bien que la prévalence de l’asthme varie selon l’âge de référence et le pays, les données actuelles suggèrent que cette maladie touche environ 13,7 % des enfants âgés de 13 à 14 ans et 11,6 % de ceux âgés de 6 à 7 ans dans le monde. L’asthme sévère, quant à lui, touche 0,5 % de la population pédiatrique générale et concerne 4,5 % des enfants asthmatiques.2
Les patients pédiatriques obtiennent, pour la plupart, un bon contrôle de leur maladie avec un traitement « classique » par corticoïdes inhalés et bêta-2-agonistes, et sont suivis par le pédiatre ou le médecin généraliste ; cependant, un certain nombre, notamment ceux avec un asthme difficile à contrôler ou un asthme sévère, a besoin d’une consultation plus spécialisée pour évaluer comment obtenir un contrôle de la maladie, en proposant parfois un traitement par anticorps monoclonaux.
Parmi les biothérapies aujourd’hui disponibles pour l’asthme (y compris l’asthme pédiatrique), il est important de ne pas oublier l’immunothérapie allergénique (ITA), disponible et remboursée en France pour les allergènes respiratoires sous forme sublinguale, en gouttes ou en comprimés (figure ). Ce traitement a prouvé son efficacité, non seulement dans la rhinite et/ou la rhinoconjonctivite allergiques mais aussi dans l’asthme allergique : chez l’asthmatique, il permet d’aider au contrôle des symptômes mais aussi à la diminution des doses de corticoïdes inhalés, et de retarder l’apparition d’une exacerbation, surtout chez les patients allergiques aux acariens et aux pollens.3
En pédiatrie, l’ITA est encore plus importante chez les enfants rhinitiques, puisqu’elle permet de diminuer le risque d’évolution de la marche atopique (trajectoire atopique) vers l’asthme. Cependant, dans les formes sévères d’asthme, la mise en place d’un traitement par ITA reste contre-indiquée ;3 pour ces patients, des anticorps monoclonaux sont désormais disponibles.
Alors que l’initiation d’un traitement par ITA peut être effectuée en ville, les autres biothérapies dans l’asthme doivent être prescrites par un médecin expérimenté dans le diagnostic et le traitement de l’asthme sévère travaillant dans un établissement de santé ; le renouvellement peut être prescrit en ville, par certains spécialistes. Toutefois le médecin traitant assure le suivi de l’enfant traité par biothérapie, et doit donc être capable de l’aiguiller dans l’observance, de l’alerter sur les effets indésirables, ou de répondre à toute question au cours du suivi, en lien direct avec le spécialiste si besoin. En France, quatre produits biologiques sont remboursés dans l’asthme pédiatrique :4 l’omalizumab, le mépolizumab, le dupilumab, et le tézépélumab (figure ).
L’asthme de l’enfant, exactement comme celui de l’adulte, se classe en intermittent ou persistant. L’asthme intermittent est caractérisé par des symptômes qui surviennent seulement à certaines périodes, et l’enfant n’a pas besoin d’un traitement de fond, mais exclusivement à la demande. Si les symptômes restent perceptibles entre deux crises, on parle d’asthme persistant, qui est qualifié de léger, modéré ou sévère. Le degré de sévérité est aujourd’hui défini par la charge thérapeutique nécessaire pour obtenir le contrôle des symptômes.
Bien que la prévalence de l’asthme varie selon l’âge de référence et le pays, les données actuelles suggèrent que cette maladie touche environ 13,7 % des enfants âgés de 13 à 14 ans et 11,6 % de ceux âgés de 6 à 7 ans dans le monde. L’asthme sévère, quant à lui, touche 0,5 % de la population pédiatrique générale et concerne 4,5 % des enfants asthmatiques.2
Les patients pédiatriques obtiennent, pour la plupart, un bon contrôle de leur maladie avec un traitement « classique » par corticoïdes inhalés et bêta-2-agonistes, et sont suivis par le pédiatre ou le médecin généraliste ; cependant, un certain nombre, notamment ceux avec un asthme difficile à contrôler ou un asthme sévère, a besoin d’une consultation plus spécialisée pour évaluer comment obtenir un contrôle de la maladie, en proposant parfois un traitement par anticorps monoclonaux.
Parmi les biothérapies aujourd’hui disponibles pour l’asthme (y compris l’asthme pédiatrique), il est important de ne pas oublier l’immunothérapie allergénique (ITA), disponible et remboursée en France pour les allergènes respiratoires sous forme sublinguale, en gouttes ou en comprimés (
En pédiatrie, l’ITA est encore plus importante chez les enfants rhinitiques, puisqu’elle permet de diminuer le risque d’évolution de la marche atopique (trajectoire atopique) vers l’asthme. Cependant, dans les formes sévères d’asthme, la mise en place d’un traitement par ITA reste contre-indiquée ;3 pour ces patients, des anticorps monoclonaux sont désormais disponibles.
Alors que l’initiation d’un traitement par ITA peut être effectuée en ville, les autres biothérapies dans l’asthme doivent être prescrites par un médecin expérimenté dans le diagnostic et le traitement de l’asthme sévère travaillant dans un établissement de santé ; le renouvellement peut être prescrit en ville, par certains spécialistes. Toutefois le médecin traitant assure le suivi de l’enfant traité par biothérapie, et doit donc être capable de l’aiguiller dans l’observance, de l’alerter sur les effets indésirables, ou de répondre à toute question au cours du suivi, en lien direct avec le spécialiste si besoin. En France, quatre produits biologiques sont remboursés dans l’asthme pédiatrique :4 l’omalizumab, le mépolizumab, le dupilumab, et le tézépélumab (
Mécanismes physiopathologiques sous-tendant l’efficacité des biothérapies dans l’asthme
Il est important de distinguer l’asthme de type 2 (T2) de l’asthme non T2 (qui reste aujourd’hui un critère d’exclusion des biothérapies). Dans cet article, nous nous intéressons principalement aux thérapies ciblant l’inflammation T2.
Les biomarqueurs principaux de l’inflammation T2 sont les cyto-kines interleukine 4 (IL-4), IL-5, IL-13, l’éosinophilie périphérique, la fraction exhalée d’oxyde nitrique (FeNO)* et le taux d’immunoglobulines E (IgE) totales et spécifiques.2
Actuellement, un asthme T2 se définit par un taux d’éosinophiles circulant supérieur ou égal à 150/μL, et/ou une augmentation de la FeNO supérieure ou égale à 20 ppb (parts par milliard en volume) et/ou la présence d’éosinophiles dans les expectorations (2 % ou plus) et/ou un asthme d’origine allergique selon l’évaluation clinique et/ou un asthme corticodépendant.1
L’asthme avec inflammation T2 est caractérisé par une hyper-réactivité bronchique et une inflammation qui peut être induite par différents agents et cellules.5 Dans l’asthme allergique, l’antigène, capté par des cellules présentatrices de l’antigène, est présenté aux cellules T naïves permettant leur différenciation en Th2 fonctionnelles. Ces lymphocytes produisent alors des cytokines IL-4, 5 et 13, permettant la différenciation des lymphocytes B en plasmocytes producteurs d’IgE. Par un rétrocontrôle positif, l’IL-4 stimule à son tour la différenciation Th2 des cellules T naïves. Ces IgE arment les cellules de l’immunité innée, notamment les basophiles et les mastocytes, en se fixant à leur récepteur à haute affinité.5 Puis les mastocytes et les basophiles sécrètent à leur tour des cytokines IL-4, 5 et 13 : une telle réponse ne stimule pas seulement la production d’IgE mais conduit en même temps à une augmentation de l’éosinophilie périphérique et tissulaire, sans stimulation spécifique de la part d’un allergène.5 Dans les formes d’asthme où l’exposition à l’allergène est clairement en lien avec l’apparition des symptômes ou les exacerbations, cette voie pourrait être ciblée, en bloquant les IgE responsables de la cascade inflammatoire. En l’absence d’élévation des IgE, mais en cas d’éosinophilie, ces dernières cellules pourraient être la cible du traitement. La présence d’IL-4, IL-13 et autres médiateurs, et la dégranulation des éosinophiles provoquent aussi la contraction des cellules musculaires lisses, l’hypertrophie et le dépôt de collagène dans les parois des voies respiratoires, et, finalement, le remodelage des voies respiratoires. Par conséquent, dans les cas de schémas mixtes sans prédominance claire d’allergie, une option valable reste l’inhibition à la fois de l’IL-4 et de l’IL-13.5
Plus récemment, de nouvelles études se sont focalisées sur le rôle des alarmines produites en réponse à des agressions environnementales telles que les allergènes, la fumée de cigarette, les polluants atmosphériques, les virus, les irritants chimiques et physiques ; elles jouent un rôle clé dans le déclenchement et la persistance de l’inflammation des voies respiratoires dans l’asthme. Leur surexpression semble être corrélée à la sévérité de l’asthme, à la diminution des débits bronchiques et à la résistance aux corticoïdes ; ces molécules sont donc une autre cible possible du traitement de l’asthme sévère T2.5
Les biomarqueurs principaux de l’inflammation T2 sont les cyto-kines interleukine 4 (IL-4), IL-5, IL-13, l’éosinophilie périphérique, la fraction exhalée d’oxyde nitrique (FeNO)* et le taux d’immunoglobulines E (IgE) totales et spécifiques.2
Actuellement, un asthme T2 se définit par un taux d’éosinophiles circulant supérieur ou égal à 150/μL, et/ou une augmentation de la FeNO supérieure ou égale à 20 ppb (parts par milliard en volume) et/ou la présence d’éosinophiles dans les expectorations (2 % ou plus) et/ou un asthme d’origine allergique selon l’évaluation clinique et/ou un asthme corticodépendant.1
L’asthme avec inflammation T2 est caractérisé par une hyper-réactivité bronchique et une inflammation qui peut être induite par différents agents et cellules.5 Dans l’asthme allergique, l’antigène, capté par des cellules présentatrices de l’antigène, est présenté aux cellules T naïves permettant leur différenciation en Th2 fonctionnelles. Ces lymphocytes produisent alors des cytokines IL-4, 5 et 13, permettant la différenciation des lymphocytes B en plasmocytes producteurs d’IgE. Par un rétrocontrôle positif, l’IL-4 stimule à son tour la différenciation Th2 des cellules T naïves. Ces IgE arment les cellules de l’immunité innée, notamment les basophiles et les mastocytes, en se fixant à leur récepteur à haute affinité.5 Puis les mastocytes et les basophiles sécrètent à leur tour des cytokines IL-4, 5 et 13 : une telle réponse ne stimule pas seulement la production d’IgE mais conduit en même temps à une augmentation de l’éosinophilie périphérique et tissulaire, sans stimulation spécifique de la part d’un allergène.5 Dans les formes d’asthme où l’exposition à l’allergène est clairement en lien avec l’apparition des symptômes ou les exacerbations, cette voie pourrait être ciblée, en bloquant les IgE responsables de la cascade inflammatoire. En l’absence d’élévation des IgE, mais en cas d’éosinophilie, ces dernières cellules pourraient être la cible du traitement. La présence d’IL-4, IL-13 et autres médiateurs, et la dégranulation des éosinophiles provoquent aussi la contraction des cellules musculaires lisses, l’hypertrophie et le dépôt de collagène dans les parois des voies respiratoires, et, finalement, le remodelage des voies respiratoires. Par conséquent, dans les cas de schémas mixtes sans prédominance claire d’allergie, une option valable reste l’inhibition à la fois de l’IL-4 et de l’IL-13.5
Plus récemment, de nouvelles études se sont focalisées sur le rôle des alarmines produites en réponse à des agressions environnementales telles que les allergènes, la fumée de cigarette, les polluants atmosphériques, les virus, les irritants chimiques et physiques ; elles jouent un rôle clé dans le déclenchement et la persistance de l’inflammation des voies respiratoires dans l’asthme. Leur surexpression semble être corrélée à la sévérité de l’asthme, à la diminution des débits bronchiques et à la résistance aux corticoïdes ; ces molécules sont donc une autre cible possible du traitement de l’asthme sévère T2.5
Omalizumab, anti-immunoglobuline E, premier à avoir été commercialisé
L’omalizumab, premier à avoir été mis sur le marché, en Europe en 2003 et en France à partir de 2006, est un anticorps monoclonal humanisé recombinant dirigé contre les IgE (tableau ).
Théoriquement, il serait utile d’évaluer des biomarqueurs spécifiques de réponse au traitement. Actuellement, les deux biomarqueurs qui semblent être liés à une meilleure réponse à l’omalizumab sont un taux de FeNO augmenté et la présence d’éosinophiles périphériques en nombre élevé. En effet, bien que l’omalizumab soit dirigé contre les IgE, leur taux semble être un mauvais facteur prédictif de réponse, et il n’y a pas d’intérêt à leur dosage au cours du traitement, car il risque d’être augmenté par réduction du catabolisme et formation de complexes IgE-omalizumab.6-8
Ce traitement est indiqué à partir de l’âge de 6 ans pour les asthmes allergiques persistants sévères avec sensibilisation allergique perannuelle, non contrôlés malgré un traitement associant bêta-2-mimétiques à longue durée d’action (B2LA) et corticostéroïdes inhalés (CSI) à forte dose, et avec altération de la fonction respiratoire (volume expiratoire maximal par seconde [VEMS] inférieur à 80 %) si le patient a plus de 12 ans.4
Le traitement est administré toutes les deux à quatre semaines à une dose définie en fonction du poids du patient et de son taux d’IgE totales : de 75 mg à 600 mg. L’administration se fait par voie sous-cutanée au moyen de seringues préremplies, dosées à 75 ou 150 mg.4
Les effets indésirables les plus fréquents sont des céphalées et des réactions au point d’injection à type de prurit, rougeur, œdème et douleur. Chez les enfants de moins de 12 ans, des céphalées, de la fièvre et des douleurs abdominales hautes ont été spécifiquement rapportées. Les réactions restent d’intensité légère à modérée.4,8 Les accidents anaphylactiques décrits aux États-Unis ne sont pas observés en Europe.
Actuellement, l’omalizumab est aussi autorisé en France pour le traitement de l’urticaire chronique spontanée de l’adolescent et de l’adulte et de la polypose nasosinusienne de l’adulte.4
Théoriquement, il serait utile d’évaluer des biomarqueurs spécifiques de réponse au traitement. Actuellement, les deux biomarqueurs qui semblent être liés à une meilleure réponse à l’omalizumab sont un taux de FeNO augmenté et la présence d’éosinophiles périphériques en nombre élevé. En effet, bien que l’omalizumab soit dirigé contre les IgE, leur taux semble être un mauvais facteur prédictif de réponse, et il n’y a pas d’intérêt à leur dosage au cours du traitement, car il risque d’être augmenté par réduction du catabolisme et formation de complexes IgE-omalizumab.6-8
Ce traitement est indiqué à partir de l’âge de 6 ans pour les asthmes allergiques persistants sévères avec sensibilisation allergique perannuelle, non contrôlés malgré un traitement associant bêta-2-mimétiques à longue durée d’action (B2LA) et corticostéroïdes inhalés (CSI) à forte dose, et avec altération de la fonction respiratoire (volume expiratoire maximal par seconde [VEMS] inférieur à 80 %) si le patient a plus de 12 ans.4
Le traitement est administré toutes les deux à quatre semaines à une dose définie en fonction du poids du patient et de son taux d’IgE totales : de 75 mg à 600 mg. L’administration se fait par voie sous-cutanée au moyen de seringues préremplies, dosées à 75 ou 150 mg.4
Les effets indésirables les plus fréquents sont des céphalées et des réactions au point d’injection à type de prurit, rougeur, œdème et douleur. Chez les enfants de moins de 12 ans, des céphalées, de la fièvre et des douleurs abdominales hautes ont été spécifiquement rapportées. Les réactions restent d’intensité légère à modérée.4,8 Les accidents anaphylactiques décrits aux États-Unis ne sont pas observés en Europe.
Actuellement, l’omalizumab est aussi autorisé en France pour le traitement de l’urticaire chronique spontanée de l’adolescent et de l’adulte et de la polypose nasosinusienne de l’adulte.4
Mépolizumab, un anti-interleukine 5 évalué sur le taux d’éosinophiles circulants
Le mépolizumab est un anticorps monoclonal humanisé recombinant, disponible depuis 2015, qui se lie sélectivement à l’IL-5 circulante empêchant toute interaction avec son récepteur (tableau ). Il a la particularité d’entraîner une déplétion rapide certes (en un mois) mais incomplète des éosinophiles. Le taux d’éosinophiles circulants semble être le meilleur biomarqueur prédictif d’une bonne réponse thérapeutique.9
Ce traitement est indiqué à partir de l’âge de 6 ans pour les patients atteints d’asthme éosinophilique sévère réfractaire (taux d’éosinophiles périphériques supérieur à 0,15 G/L), avec au moins deux exacerbations asthmatiques au cours des douze mois précédant le début de la biothérapie, malgré un traitement de fond par B2LA et CSI à forte dose, ou ayant nécessité un traitement par corticothérapie orale (CSO) pendant au moins six mois au cours des douze derniers mois.4
La posologie recommandée est de 100 mg toutes les quatre semaines à partir de l’âge de 12 ans et de 40 mg toutes les quatre semaines chez les enfants âgés de 6 à 11 ans ; l’administration, sous-cutanée, se fait par stylos auto-injectables ou seringues préremplies pour la posologie de 100 mg, ou avec une solution injectable en seringues préremplies pour la posologie de 40 mg.4
Les effets indésirables décrits restent d’intensité légère à modérée ; les plus fréquents semblent inclure des céphalées, des réactions locales au site d’injection et des épisodes de dorsalgie.4,8
Actuellement, le mépolizumab est aussi autorisé pour le traitement de la polypose nasosinusienne de l’adulte, la granulomatose éosinophilique avec polyangéite chez l’adulte et l’adolescent de plus de 12 ans et pour le syndrome hyperéosinophilique chez l’adulte.4
Ce traitement est indiqué à partir de l’âge de 6 ans pour les patients atteints d’asthme éosinophilique sévère réfractaire (taux d’éosinophiles périphériques supérieur à 0,15 G/L), avec au moins deux exacerbations asthmatiques au cours des douze mois précédant le début de la biothérapie, malgré un traitement de fond par B2LA et CSI à forte dose, ou ayant nécessité un traitement par corticothérapie orale (CSO) pendant au moins six mois au cours des douze derniers mois.4
La posologie recommandée est de 100 mg toutes les quatre semaines à partir de l’âge de 12 ans et de 40 mg toutes les quatre semaines chez les enfants âgés de 6 à 11 ans ; l’administration, sous-cutanée, se fait par stylos auto-injectables ou seringues préremplies pour la posologie de 100 mg, ou avec une solution injectable en seringues préremplies pour la posologie de 40 mg.4
Les effets indésirables décrits restent d’intensité légère à modérée ; les plus fréquents semblent inclure des céphalées, des réactions locales au site d’injection et des épisodes de dorsalgie.4,8
Actuellement, le mépolizumab est aussi autorisé pour le traitement de la polypose nasosinusienne de l’adulte, la granulomatose éosinophilique avec polyangéite chez l’adulte et l’adolescent de plus de 12 ans et pour le syndrome hyperéosinophilique chez l’adulte.4
Dupilumab, anti-interleukine-4-Rα : trois ans de recul dans l’asthme sévère
Le dupilumab est un anticorps monoclonal humain recombinant dirigé contre le récepteur alpha de l’IL-4, commercialisé en France depuis 2018 pour le traitement de la dermatite atopique et depuis 2020 dans le cadre de l’asthme sévère (tableau ).
Il est destiné aux patients âgés d’au moins 6 ans ayant un asthme sévère avec inflammation T2, caractérisé par un taux d’éosinophiles circulants supérieur à 0,15 G/L et /ou une FeNO élevée, et des symptômes non contrôlés, malgré un traitement de fond.4,10
Sa posologie varie entre 100 et 300 mg toutes les deux ou quatre semaines, avec une dose doublée lors de la première injection. Il est disponible en stylo auto-injectable et en seringue préremplie de 200 et 300 mg.4
Les effets indésirables les plus communs incluent réactions locales, arthralgies, herpès buccaux, hyperéosinophilie et conjonctivites. Exceptionnellement, les patients risquent de présenter une maladie sérique, une kératite ulcérative et des épisodes d’anaphylaxie.4
Actuellement, le dupilumab est également autorisé en France pour le traitement de la dermatite atopique à partir de l’âge de 6 mois, de l’œsophagite à éosinophiles à partir de l’âge de 12 ans, et de la polypose nasosinusienne de l’adulte.4
Il est destiné aux patients âgés d’au moins 6 ans ayant un asthme sévère avec inflammation T2, caractérisé par un taux d’éosinophiles circulants supérieur à 0,15 G/L et /ou une FeNO élevée, et des symptômes non contrôlés, malgré un traitement de fond.4,10
Sa posologie varie entre 100 et 300 mg toutes les deux ou quatre semaines, avec une dose doublée lors de la première injection. Il est disponible en stylo auto-injectable et en seringue préremplie de 200 et 300 mg.4
Les effets indésirables les plus communs incluent réactions locales, arthralgies, herpès buccaux, hyperéosinophilie et conjonctivites. Exceptionnellement, les patients risquent de présenter une maladie sérique, une kératite ulcérative et des épisodes d’anaphylaxie.4
Actuellement, le dupilumab est également autorisé en France pour le traitement de la dermatite atopique à partir de l’âge de 6 mois, de l’œsophagite à éosinophiles à partir de l’âge de 12 ans, et de la polypose nasosinusienne de l’adulte.4
Tézépélumab, anti-lymphopoïétine stromale thymique : aussi dans l’asthme non T2
Le tézépélumab est un anticorps monoclonal humain dirigé contre la lymphopoïétine stromale thymique (TSLP), empêchant toute interaction avec son récepteur (tableau ).11
Actuellement, il est indiqué chez l’adulte et l’enfant âgé de plus de 12 ans, en traitement de fond additionnel de l’asthme sévère non contrôlé malgré des CSI à forte dose associés à un autre traitement fond.4 Il est donc autorisé en cas d’asthme sévère T2 mais aussi en cas d’asthme sévère non T2.
Son schéma d’administration est simple, il n’existe qu’une seule posologie à 210 mg en injection sous-cutanée toutes les quatre semaines.4 L’administration se fait par des seringues préremplies et, probablement bientôt, des stylos auto-injectables.
Les effets indésirables sont principalement des arthralgies, pharyngites, éruptions cutanées ainsi que des réactions au point d’injection.4 Le profil de tolérance des adolescents et des adultes est sensiblement le même. Une étude clinique a évalué la pharmacocinétique de ce traitement chez des patients pédiatriques, à partir de l’âge de 5 ans (NCT04673630)12, et une étude de phase III sera donc bientôt réalisée.
Actuellement, il est indiqué chez l’adulte et l’enfant âgé de plus de 12 ans, en traitement de fond additionnel de l’asthme sévère non contrôlé malgré des CSI à forte dose associés à un autre traitement fond.4 Il est donc autorisé en cas d’asthme sévère T2 mais aussi en cas d’asthme sévère non T2.
Son schéma d’administration est simple, il n’existe qu’une seule posologie à 210 mg en injection sous-cutanée toutes les quatre semaines.4 L’administration se fait par des seringues préremplies et, probablement bientôt, des stylos auto-injectables.
Les effets indésirables sont principalement des arthralgies, pharyngites, éruptions cutanées ainsi que des réactions au point d’injection.4 Le profil de tolérance des adolescents et des adultes est sensiblement le même. Une étude clinique a évalué la pharmacocinétique de ce traitement chez des patients pédiatriques, à partir de l’âge de 5 ans (NCT04673630)12, et une étude de phase III sera donc bientôt réalisée.
Benralizumab, anti-interleukine-5-Rα, en cours d’étude pour une utilisation en pédiatrie
Le benralizumab est un anticorps monoclonal humanisé recombinant dirigé contre le récepteur alpha de l’IL-5 permettant une déplétion rapide et presque complète des éosinophiles. Commercialisé en France depuis 2019, il est indiqué dans l’asthme sévère de l’adulte.4,13 Malgré le fait que ce produit ne soit pas destiné à la population pédiatrique, nous le mentionnons car une étude clinique de phase III est en cours pour proposer ce traitement à des enfants, à partir de l’âge de 6 ans (NCT05692180).12
Les indications et les modalités d’administration chez l’enfant seront clarifiées après l’autorisation de mise sur le marché du produit pour cette population spécifique.
Les indications et les modalités d’administration chez l’enfant seront clarifiées après l’autorisation de mise sur le marché du produit pour cette population spécifique.
Quatre médicaments biologiques indiqués dans l’asthme sévère de l’enfant
L’amélioration de la compréhension des mécanismes de la maladie asthmatique a permis le développement de nouvelles stratégies thérapeutiques. Actuellement, plusieurs médicaments biologiques sont utilisés dans la pratique clinique médicale pour prendre en charge l’asthme sévère, y compris l’asthme sévère de l’enfant ; le médecin traitant (pédiatre ou généraliste) doit connaître ces nouveaux traitements. L’éducation thérapeutique est une étape clé pour le patient et la famille. Le médecin traitant doit pouvoir suivre, évaluer l’enfant dans sa globalité, et ne pas oublier les comorbidités qui peuvent se greffer à la pathologie asthmatique.
Chez les patients allergiques et asthmatiques, l’ITA reste le seul traitement capable de modifier l’histoire naturelle de la maladie et d’aider au contrôle des symptômes et à la réduction des traitements symptomatiques.
Depuis la mise sur le marché des anticorps monoclonaux, il existe, même en pédiatrie, des solutions capables de cibler des molécules ou cellules clés dans l’inflammation qui caractérise l’asthme. Les anticorps monoclonaux sont effectivement capables d’apporter rapidement un contrôle des symptômes chez la plupart des patients. Malheureusement, ces thérapies ne sont pas associées à une modification de l’histoire naturelle de la maladie et, une fois arrêtées, les patients ont de nouveau, après un délai différent, des symptômes d’asthme plus ou moins sévères. Toutefois, les anticorps monoclonaux constituent aujourd’hui le meilleur choix thérapeutique en cas d’asthme sévère de l’enfant, si les traitements classiques ne sont pas efficaces pour contrôler la maladie. Bien sûr, il faut tout d’abord s’assurer que le diagnostic d’asthme est correct, après avoir écarté les possibles diagnostics différentiels, que l’observance du patient est optimisée, et que les facteurs de risque de non-contrôle et d’exacerbation sont minimisés et maîtrisés par l’enfant et la famille. Si, malgré une prise en charge holistique de la maladie de l’enfant, l’asthme reste non contrôlé, il est impératif de penser à la possibilité de prescrire un anticorps monoclonal et adresser l’enfant à un établissement de santé, pour que son dossier soit discuté en réunion de concertation d’équipe ou multidisciplinaire, pour choisir, entre experts, la molécule la plus adaptée à chaque patient. Il va de soi que le lien entre le pédiatre ou le médecin généraliste et le spécialiste reste fondamental pour une coordination des soins et une meilleure prise en charge des enfants asthmatiques.
Chez les patients allergiques et asthmatiques, l’ITA reste le seul traitement capable de modifier l’histoire naturelle de la maladie et d’aider au contrôle des symptômes et à la réduction des traitements symptomatiques.
Depuis la mise sur le marché des anticorps monoclonaux, il existe, même en pédiatrie, des solutions capables de cibler des molécules ou cellules clés dans l’inflammation qui caractérise l’asthme. Les anticorps monoclonaux sont effectivement capables d’apporter rapidement un contrôle des symptômes chez la plupart des patients. Malheureusement, ces thérapies ne sont pas associées à une modification de l’histoire naturelle de la maladie et, une fois arrêtées, les patients ont de nouveau, après un délai différent, des symptômes d’asthme plus ou moins sévères. Toutefois, les anticorps monoclonaux constituent aujourd’hui le meilleur choix thérapeutique en cas d’asthme sévère de l’enfant, si les traitements classiques ne sont pas efficaces pour contrôler la maladie. Bien sûr, il faut tout d’abord s’assurer que le diagnostic d’asthme est correct, après avoir écarté les possibles diagnostics différentiels, que l’observance du patient est optimisée, et que les facteurs de risque de non-contrôle et d’exacerbation sont minimisés et maîtrisés par l’enfant et la famille. Si, malgré une prise en charge holistique de la maladie de l’enfant, l’asthme reste non contrôlé, il est impératif de penser à la possibilité de prescrire un anticorps monoclonal et adresser l’enfant à un établissement de santé, pour que son dossier soit discuté en réunion de concertation d’équipe ou multidisciplinaire, pour choisir, entre experts, la molécule la plus adaptée à chaque patient. Il va de soi que le lien entre le pédiatre ou le médecin généraliste et le spécialiste reste fondamental pour une coordination des soins et une meilleure prise en charge des enfants asthmatiques.
Références
1. Clark E, Tabardel M, Bouderbala Y, Demoly P, Caimmi D. Les biothérapies dans l’asthme sévère de l’enfant. Bull Acad Natl Med 2023;207(5):619-625.
2. Lang A, Carlsen KH, Haaland G, Devulapalli CS, Munthe-Kaas M, Mowinckel P, et al. Severe asthma in childhood: Assessed in 10-year olds in a birth cohort study. Allergy 2008;63(8):1054-60.
3. Caimmi D, Demoly P. Recommandations pour la prescription de l’immunothérapie allergénique et le suivi du patient. Méthodologie et liste des recommandations. Rev Fr Allergol 2021;61(1):24-34.
4. Base de données publique des médicaments. Agence nationale des médicaments et des produits de santé (ANSM). https://base-donnees-publique.medicaments.gouv.fr
5. Tabardel M, Clark E, Demoly P, Caimmi D. Les anticorps monoclonaux à disposition des allergologues pour traiter l’asthme sévère. Rev Fr Allergol 2022;62(6):572-7.
6. Wangberg H, Woessner K. Choice of biologics in asthma endotypes. Curr Opin Allergy Clin Immunol 2021;21(1):79-85.
7. Fajt ML, Wenzel SE. Development of new therapies for severe asthma. Allergy Asthma Immunol Res 2017;9(1):3.
8. Agache I, Beltran J, Akdis C, Akdis M, Canelo-AybarC, Canonica GW, et al. Efficacy and safety of treatment with biologicals (benralizumab, dupilumab, mepolizumab, omalizumab and reslizumab) for severe eosinophilic asthma. A systematic review for the EAACI Guidelines ‐ recommendations on the use of biologicals in severe asthma. Allergy 2020;75(5):1023-42.
9. Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med 2014;371(13):1198-207.
10. Corren J, Castro M, O’Riordan T, Hanania NA, Pavord ID, Quirce S, et al. Dupilumab efficacy in patients with uncontrolled, moderate-to-severe allergic asthma. J Allergy Clin Immunol Pract 2020;8(2):516-26.
11. Corren J, Parnes JR, Wang L, Mo M, Roseti SL, Griffiths JM, et al. Tezepelumab in adults with uncontrolled asthma. N Engl J Med 2017;377(10):936-46.
12. ClinicalTrials.gov, National Institutes of Health (NIH), National Library of Medicine. http://www.clinicaltrials.gov (consulté le 24 juin 2023).
13. Bleecker ER, Fitzgerald JM, Chanez P, Papi A, Weinstein SF, Barker P, et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting β2-agonists (SIROCCO): A randomised, multicentre, placebo-controlled phase 3 trial. The Lancet 2016;388(10056):2115-27.
2. Lang A, Carlsen KH, Haaland G, Devulapalli CS, Munthe-Kaas M, Mowinckel P, et al. Severe asthma in childhood: Assessed in 10-year olds in a birth cohort study. Allergy 2008;63(8):1054-60.
3. Caimmi D, Demoly P. Recommandations pour la prescription de l’immunothérapie allergénique et le suivi du patient. Méthodologie et liste des recommandations. Rev Fr Allergol 2021;61(1):24-34.
4. Base de données publique des médicaments. Agence nationale des médicaments et des produits de santé (ANSM). https://base-donnees-publique.medicaments.gouv.fr
5. Tabardel M, Clark E, Demoly P, Caimmi D. Les anticorps monoclonaux à disposition des allergologues pour traiter l’asthme sévère. Rev Fr Allergol 2022;62(6):572-7.
6. Wangberg H, Woessner K. Choice of biologics in asthma endotypes. Curr Opin Allergy Clin Immunol 2021;21(1):79-85.
7. Fajt ML, Wenzel SE. Development of new therapies for severe asthma. Allergy Asthma Immunol Res 2017;9(1):3.
8. Agache I, Beltran J, Akdis C, Akdis M, Canelo-AybarC, Canonica GW, et al. Efficacy and safety of treatment with biologicals (benralizumab, dupilumab, mepolizumab, omalizumab and reslizumab) for severe eosinophilic asthma. A systematic review for the EAACI Guidelines ‐ recommendations on the use of biologicals in severe asthma. Allergy 2020;75(5):1023-42.
9. Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med 2014;371(13):1198-207.
10. Corren J, Castro M, O’Riordan T, Hanania NA, Pavord ID, Quirce S, et al. Dupilumab efficacy in patients with uncontrolled, moderate-to-severe allergic asthma. J Allergy Clin Immunol Pract 2020;8(2):516-26.
11. Corren J, Parnes JR, Wang L, Mo M, Roseti SL, Griffiths JM, et al. Tezepelumab in adults with uncontrolled asthma. N Engl J Med 2017;377(10):936-46.
12. ClinicalTrials.gov, National Institutes of Health (NIH), National Library of Medicine. http://www.clinicaltrials.gov (consulté le 24 juin 2023).
13. Bleecker ER, Fitzgerald JM, Chanez P, Papi A, Weinstein SF, Barker P, et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting β2-agonists (SIROCCO): A randomised, multicentre, placebo-controlled phase 3 trial. The Lancet 2016;388(10056):2115-27.
Dans cet article
- Mécanismes physiopathologiques sous-tendant l’efficacité des biothérapies dans l’asthme
- Omalizumab, anti-immunoglobuline E, premier à avoir été commercialisé
- Mépolizumab, un anti-interleukine 5 évalué sur le taux d’éosinophiles circulants
- Dupilumab, anti-interleukine-4-Rα : trois ans de recul dans l’asthme sévère
- Tézépélumab, anti-lymphopoïétine stromale thymique : aussi dans l’asthme non T2
- Benralizumab, anti-interleukine-5-Rα, en cours d’étude pour une utilisation en pédiatrie
- Quatre médicaments biologiques indiqués dans l’asthme sévère de l’enfant