Les gammapathies monoclonales de signification indéterminée – ou MGUS, leur sigle en anglais – sont des gammapathies monoclonales isolées sans manifestations cliniques, biologiques ou radiologiques qui correspondent à des états précancéreux évocateurs d’une hémopathie maligne. Elles représentent la majorité (plus de 60 %) des gammapathies monoclonales. Ces anomalies se définissent par l’excès d’une immunoglobuline monoclonale dans le sang ou les urines, qui traduit la prolifération potentiellement cancéreuse d’un clone de plasmocytes. La prévalence des MGUS dans la population générale est estimée à 3,2 % au-delà de 50 ans. Elle augmente avec l’âge pour atteindre 5 % au-delà de 70 ans, et 6,6 à 10 % au-delà de 80 ans. De par leur fréquence, les MGUS sont souvent découvertes de façon fortuite chez le sujet âgé, à l’électrophorèse des protéines.
En pratique, face à ces anomalies, la conduite à tenir n’est pas simple. Deux récentes revues de la littérature, parues en 2025 dans le JAMA Internal Medicine et dans le NEJM, reviennent sur les MGUS et font le point sur son diagnostic et sa prise en charge.
Risque de transformation tumorale
Le risque d’évolution des MGUS vers une hémopathie maligne est faible, estimé à environ 1 % par an et persiste avec le temps, tandis que 90 à 100 % des myélomes multiples sont précédés par une gammapathie monoclonale de signification indéterminée. Le risque de progression de la maladie vers une tumeur ainsi que le type de cancer possible varient selon l’isotype de la MGUS (cf. tableau 1).
L’International Myeloma Working Group a proposé un score prédictif du risque de transformation maligne de la MGUS tenant compte de trois facteurs : l’isotype (IgG ou autre), le rapport κ/λ (normal [traditionnellement 0,26 - 1,65, mais une nouvelle définition* prenant en compte l’âge et la fonction rénale réduirait les faux positifs] ou anormal), et la valeur du pic monoclonal sérique (< 15 g/L ou non). La présence de 0 à 3 indicateurs anormaux définit quatre groupes de patients ayant des risques très différents de progression tumorale, s’échelonnant de bas à élevé (cf. tableau 2).
Les symptômes suivants doivent évoquer une progression tumorale vers le myélome multiple : hypercalcémie (> 0,25 mmol/L /N ou > 2,75 mmol/L) ; insuffisance rénale (créatinine > 177 mmol/L ou clairance de la créatinine < 40 mL/min) ; anémie (hémoglobine < 2 g/dL/N ou < 10 g/dL) ; protéine monoclonale urinaire > 200 mg/24 heures ; rapport κ/λ ou λ/κ ≥ 100 avec concentration de la chaîne légère monoclonale en excès ≥ 100 mg/L.
Les symptômes suivants doivent évoquer une progression tumorale vers la maladie de Waldenström : anémie, symptômes généraux (fièvre, perte de poids, etc.), hyperviscosité, adénopathie ou hépatosplénomégalie (si attribuables à la prolifération clonale anormale sous-jacente).
Gammapathie monoclonale de signification clinique
Hormis la transformation tumorale, la MGUS peut également évoluer vers une gammapathie monoclonale de signification clinique (MGCS), un ensemble de troubles rares sans hémopathie maligne avérée, dont les principaux exemples sont listés dans le tableau 3. Leurs manifestations peuvent prendre différentes formes. Elles sont souvent systémiques, mais touchent de préférence certains organes – notamment les reins, la peau et le système nerveux périphérique. Les symptômes qui doivent alerter sont notamment une atteinte rénale. Dans le syndrome POEMS, une des principales MGCS, on observe très fréquemment des lésions osseuses, le plus souvent asymptomatiques, focales et au moins en partie ostéocondensantes. Le syndrome de Schnitzler, une autre MGCS, est défini par l’association d’une IgM monoclonale à des épisodes récurrents d’éruptions pseudo-urticariennes. En outre, toute protéinurie notable (supérieure à 200 mg/L) doit être analysée par électrophorèse, et doit faire évoquer ce diagnostic si elle est composée d’au moins 30 % d’albumine.
L’amylose immunoglobulinique (notamment amylose AL) a, parmi les MGCS, une gravité particulière qui justifie un diagnostic le plus précoce possible : au moindre doute sur une atteinte cardiaque, le dosage de NT-pro-BNP est indiqué. Un myélome (ou une autre hémopathie) paucisécrétant reste possible, mais constitue un cas très rare.
Le diagnostic de MGCS, définitivement posé par le spécialiste, implique d’exclure l’association fortuite de la pathologie observée avec une gammapathie monoclonale de type MGUS, de grande fréquence surtout chez le sujet âgé. Il repose sur des examens immunohistologiques spécialisés, de façon à vérifier qu’il y ait identité isotypique entre les dépôts immunoglobuliniques tissulaires dans l’organe atteint et l’immunoglobuline monoclonale circulante.
Bilan et suivi : que faire ?
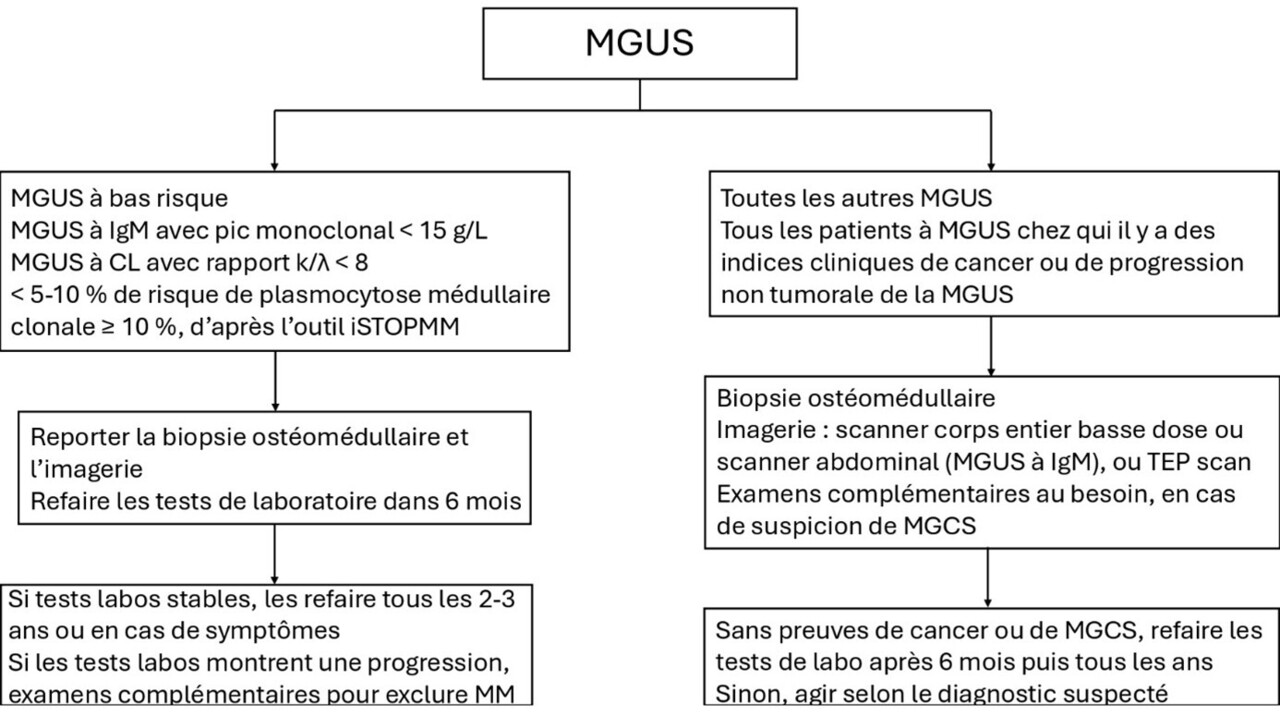
Des recommandations d’expert pour l’exploration des gammapathies monoclonales sont disponibles dans l’article suivant. L’algorithme de prise en charge récemment suggéré par la revue du NEJM est indiqué en figure.
Face à la découverte d’une MGUS, il faut commencer par établir son profil de risque, à partir du tableau 2. Pour calculer rapidement ce profil de risque, le site https ://istopmm.com/riskmodel/ peut être utilisé. Puis, selon le profil de la maladie, plusieurs possibilités se dessinent :
- MGUS à bas risque et assimilées (cf. figure) : abstention thérapeutique ; reporter la biopsie ostéomédullaire et l’imagerie, et après 6 mois réaliser les tests biologiques suivants : électrophorèse des protéines sériques, immunofixation, dosage sérique des chaînes légères libres kappa et lambda, hémogramme, calcémie, créatininémie. En cas de résultats stables, refaire ces tests tous les 2 - 3 ans ; s’ils ne sont pas stables, il faut les refaire plus souvent et éventuellement faire des examens complémentaires à la recherche d’une progression (notamment myélome multiple) ;
- Pour toutes les autres MGUS : demander une biopsie ostéomédullaire et une imagerie (scanner ou TEP scan), et si les résultats sont négatifs, refaire les tests précédemment évoqués à 6 mois, puis en cas de stabilité des résultats tous les ans. Là aussi, si les résultats biologiques ne sont pas stables, il faut les refaire plus souvent et éventuellement faire des examens complémentaires à la recherche d’une progression (notamment myélome multiple).
* : La définition traditionnelle du rapport κ/λ normal est 0,26 - 1,65, mais depuis peu, il en existe une nouvelle définition plus précise, prenant en compte l’âge et la fonction rénale, afin d’améliorer la stratification du risque des MGUS et de limiter les faux positifs. Dans cette nouvelle définition, en cas de fonction rénale normale (eGFR ≥ 60 mL/min/1,73 m2), le rapport κ/λ normal est de 0,44 - 2,16 chez les < 70 ans et de 0,46 - 2,59 pour les ≥ 70 ans. Sinon, le rapport κ/λ normal est fixé à 0,46 - 2,62 dans l’insuffisance rénale légère à modérée (eGFR = 45 - 59 mL/min/1,73 m2), à 0,48 - 3,38 dans l’insuffisance rénale modérée à sévère (eGFR = 30 - 44 mL/min/1,73 m2), et à 0,54 - 3,30 dans l’insuffisance rénale sévère à terminale (eGFR < 30 mL/min/1,73 m2).
Decaux O. Épidémiologie des gammapathies monoclonales. Rev Prat 2018;68(7):785-6.
Vincent L, Roussel M, Macro M, et al. Pic monoclonal à l’électrophorèse. Rev Prat Med Gen 2025;39(1093):37-40.
Vignon M, Bridoux F, Fermand JP. Manifestations associées aux gammapathies monoclonales. Rev Prat 2018;68(7):792-6.
Decaux O. Conduite à tenir devant une gammapathie monoclonale ? Rev Prat 2018;68(7):777-84.
iStopMM. Predicting the need for bone marrow sampling in MGUS.
Velsoe Maeng C, Rögnvaldsson S, Einarsoon Long T, et al. Revised free light chain reference intervals enhance risk stratification in monoclonal gammopathy of undetermined significance and reduce overdiagnosis. Blood Cancer J 27 mai 2025.
Landgren O, Miguel J. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet 2014.
Rajkumar SV, Kyle RA, Therneau TM, et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood 14 décembre 2020.
Rajkumar SV, Kumar S. Monoclonal Gammopathy of Undetermined Significance. N Engl J Med 2025;393:1315-26.
Pour en savoir plus :
Macro M. Item 320. Myélome multiple des os. Rev Prat 2025;75(1):101-9.
Gammapathie monoclonale isolée : quel risque d’évolution maligne ? Rev Prat (en ligne) février 2025.
Delarue R. Gammapathies monoclonales : les 10 messages clés. Rev Prat 2018;68(7):803.