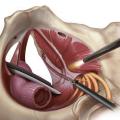
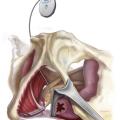
Le diagnostic de névralgie pudendale (NP) est clinique et comprend deux conditions incontournables :
- la douleur est spontanée, de forme neuropathique à type de brûlures, coups d’aiguille, fer rouge, décharges électriques. Elle répond au score du questionnaire DN4.1 C’est le plus souvent une douleur violente sur l’échelle analogique de la douleur ;
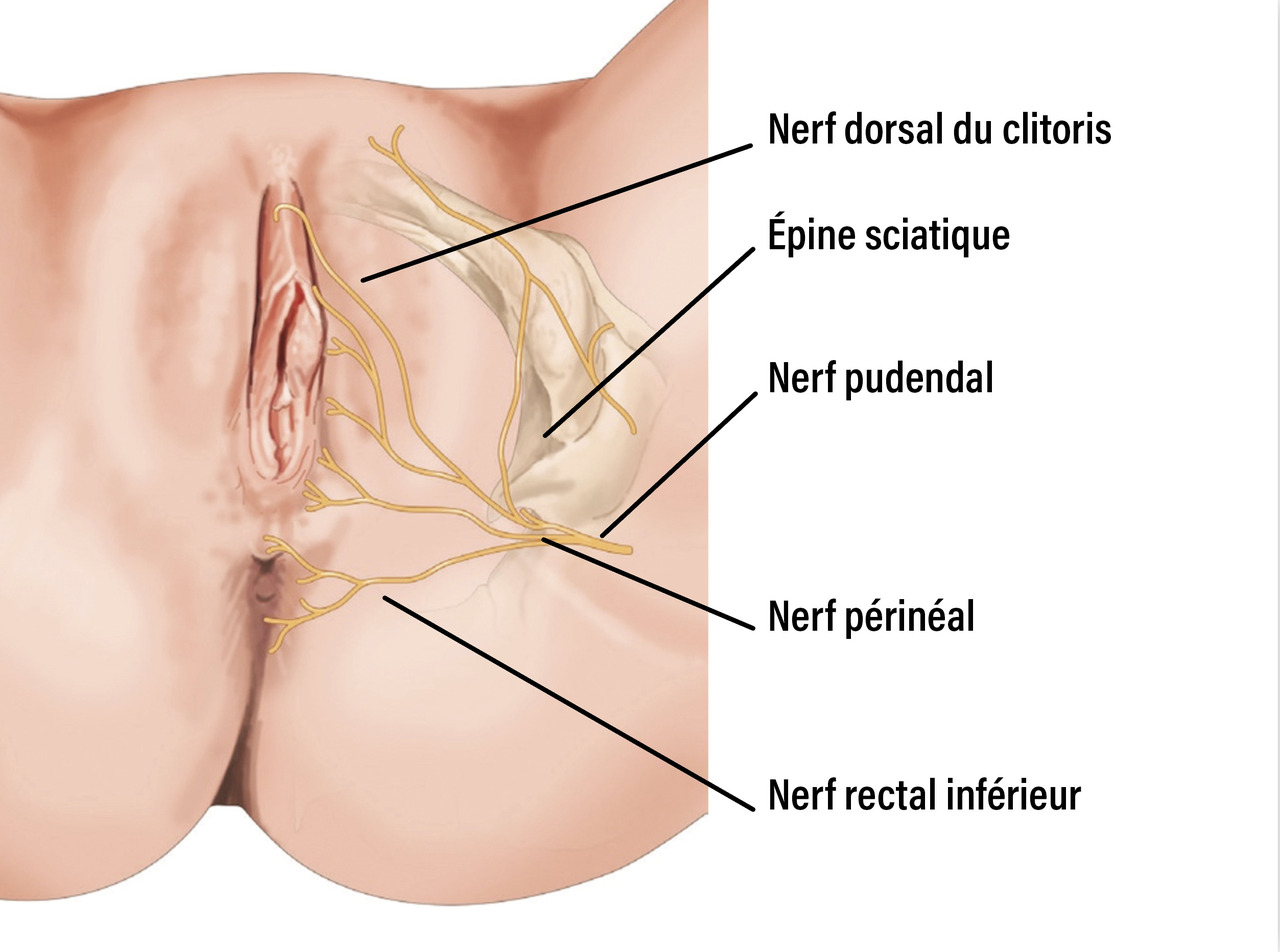
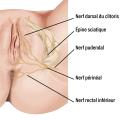
- la douleur neuropathique siège dans le territoire d’une ou des trois branches du nerf pudendal (nerf rectal inférieur, nerf périnéal, nerf dorsal du clitoris ou nerf dorsal de la verge chez l’homme). Elle peut donc intéresser la vulve chez la femme et s’associer à une douleur périnéale, anale ou clitoridienne (fig. 1). Chez l’homme, elle peut toucher l’anus, le scrotum et le périnée, la verge.
Étiologie
Les NP font partie des douleurs neuropathiques périphériques chroniques de la classification de l’International Association for the Study of Pain (IASP) pour la nouvelle CIM- 11.2 Le syndrome du canal d’Alcock en est une cause essentielle à connaître parmi de nombreuses autres qui elles, ne sont pas mécaniques.
Syndrome du canal d’Alcock
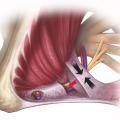
La cause la plus connue de cette neuropathie périphérique est la NP par compression canalaire (PNE pour pudendal nerve entrapment des Anglo-Saxons) ou syndrome du canal d’Alcock.
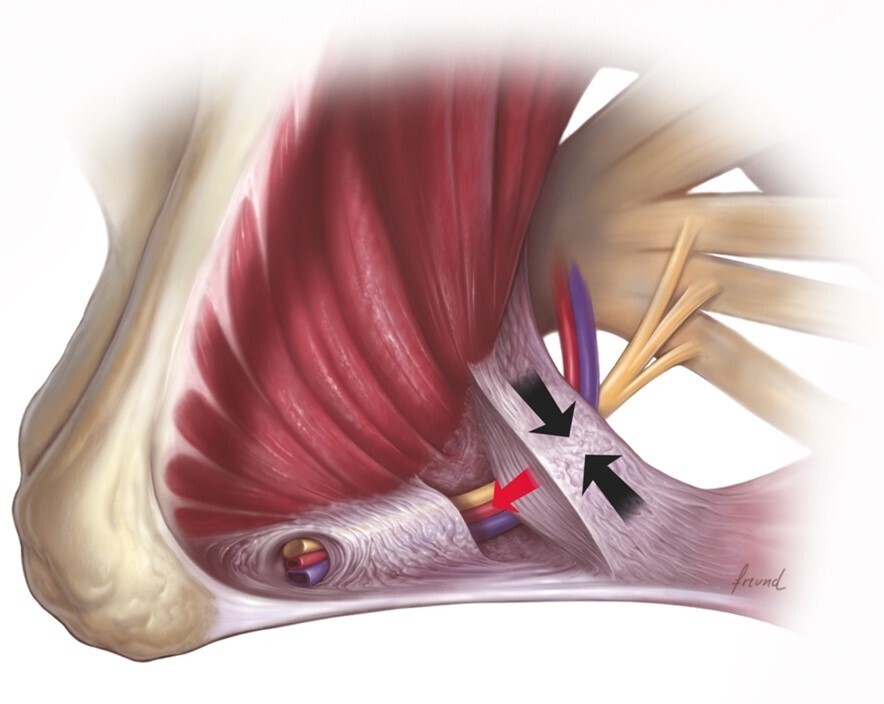
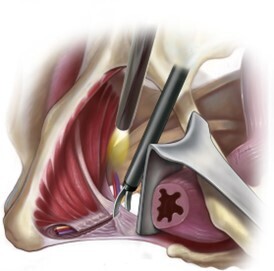
Elle est importante à diagnostiquer car c’est une des rares douleurs neuropathiques curables, par l’intervention chirurgicale de libération. La PNE est liée à la rétraction des composants du canal pudendal (le plus souvent de type fibrotique), responsable de la compression du tronc du nerf pudendal. Cette fibrose rétractile intéresse le ligament sacro-épineux et le processus faciforme, constituant le canal d’Alcock à proprement parler (fig. 2).
Le diagnostic est clinique, affirmé à l’aide des cinq critères de Nantes (encadré) :3,4 l’un des critères principaux est l’aggravation en position assise, avec amélioration en décubitus ; la douleur ne réveille pas le patient, qui s’éveille le matin sans aucune douleur. Les critères de Nantes incluent également une réponse positive au bloc-test infiltratif aux anesthésiques locaux.
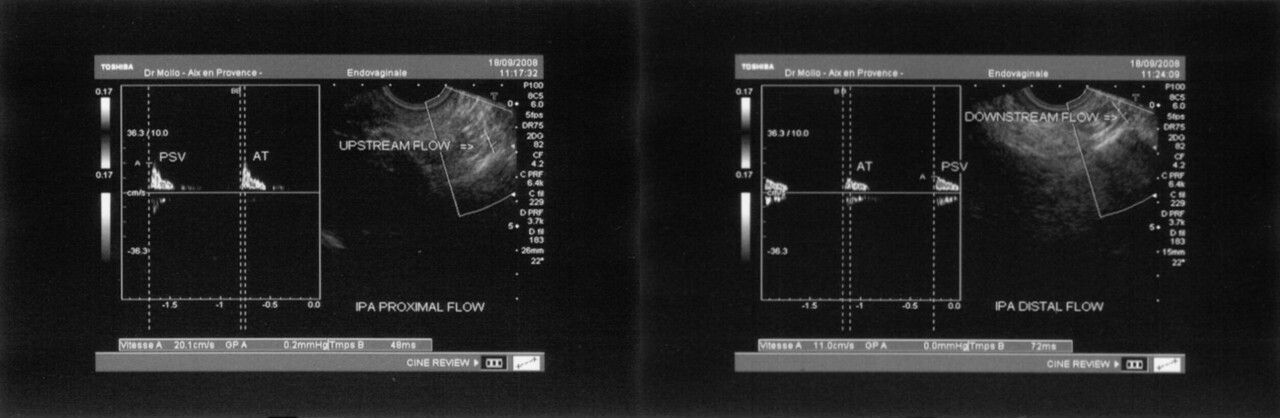
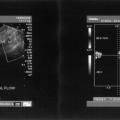
L’électromyogramme (EMG) n’est plus utilisé pour le diagnostic de compression du nerf pudendal.4,5 L’écho-Doppler des artères pudendales, en revanche, peut orienter vers le diagnostic de NP par compression canalaire, avec une bonne sensibilité (89 %), mais une spécificité de seulement 67 % (fig. 3).6
Causes « non mécaniques »
Les autres causes, dites « non canalaires », ou « non mécaniques », ont de nombreuses origines possibles.
Les neuropathies pudendales de l’accouchement dystocique sont les plus fréquentes. Décrites pour la première fois par Sultan en 1994,7 elles obéissent à des mécanismes de neuropathie à la fois d’étirement et de compression, survenant en seconde phase du travail. Elles ont été modélisées en 2005 par Lien et Delancey.8 Elles surviennent toujours en situation d’accouchement dystocique (allongement de la seconde phase du travail, instrumentation) et/ou de périmètre crânien fœtal élevé et/ou de présentation postérieure. La symptomatologie de NP pouvant débuter dans les suites immédiates de l’accouchement9 ou à distance, plus tardivement, voire chez la femme âgée.10
Les lésions neuropathiques pudendales directes sont beaucoup plus rares. Le modèle du traumatisme direct par la selle du vélo est bien connu, pouvant par ailleurs conduire à un syndrome canalaire par fibrose réactionnelle.11 Les lésions chirurgicales directes, souvent évoquées (après interventions urogynécologiques ou pour prolapsus, comme l’opération de Richter), sont en définitive peu fréquentes.
Les lésions neuropathiques métaboliques (diabète, amylose), infectieuses (herpès), pharmacologiques (chimiothérapies neuro-toxiques), auto-immune, toxiques (alcool)… peuvent concerner le nerf pudendal comme tout nerf périphérique.2
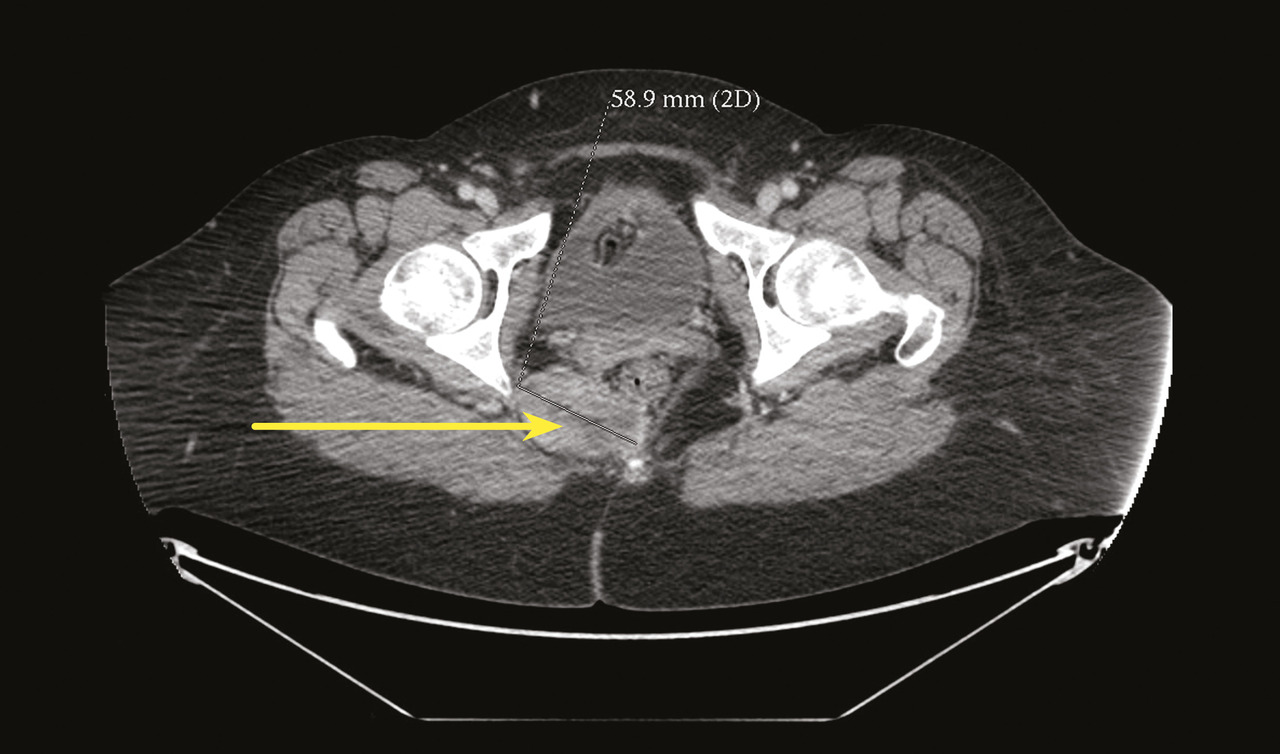
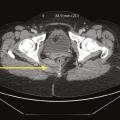
Certains phénomènes compressifs peuvent être à l’origine de NP, comme les contractures myofasciales des muscles de voisinage (muscle obturateur interne ou muscle piriforme) et certains processus tumoraux, qui bien qu’exceptionnels, doivent toujours être recherchés, imposant la réalisation d’une imagerie par résonance magnétique (IRM) ou d’un scanner pelvien (fig. 4).
Dans l’hypersensibilisation pelvienne centrale, une douleur d’allure neuropathique dans le territoire du nerf pudendal, souvent mal systématisée, est possible. L’association avec d’autres douleurs pelviennes chroniques et les critères des recommandations 2022 publiées sous l’égide de la société scientifique Convergences PP, dédiée aux douleurs pelvi-périnéales chroniques,12 permettent d’écarter une neuropathie pudendale.
Recommandations pour le traitement du syndrome du canal d’Alcock
Première ligne de traitement consensuelle
La première ligne thérapeutique est consensuelle (recommandations Convergences PP) et comprend le traitement multimodal suivant :
- gabapentinoïde (gabapentine ou prégabaline) ou antidépresseur tricyclique, de type amitriptyline, ou inhibiteur de la recapture de la sérotonine et de la noradrénaline, de type duloxétine, en cas de répercussion thymique ou d’apparition de phénomènes de sensibilisation. Les opioïdes doivent toujours être évités ;
- consignes de position assise sur coussin-bouée et évitement des positions assises traumatiques (cyclisme, équitation, motocyclette) ;
- ostéopathie, médecine manuelle et rééducation périnéale en relâchement musculaire en cas d’hypertonie associée ;4
- thérapie cognitivo-comportementale ou psychothérapie d’accompagnement souvent nécessaire, en cas de perturbations de l’humeur, voire de syndrome dépressif du fait de la sévérité de la douleur ;
- dispositifs de neurostimulation transcutanée (TENS) ;
- infiltration pudendale sous contrôle d’un électromyogramme (EMG), d’une échographie ou, le plus souvent, sous scanner. L’infiltration utilise les anesthésiques locaux. En effet, les corticoïdes n’ont pas montré d’intérêt dans cette indication.13 La réponse à l’infiltration, dite bloc-test, représente l’intérêt diagnostique initial principal de l’infiltration. Trois types de réponses peuvent être identifiées : réponse positive lorsque la réduction du score de l’échelle visuelle analogique (EVA), supérieure ou égale à 50 % du niveau initial, survient dans les deux heures qui suivent l’infiltration ; réponse négative en absence d’amélioration, y compris au cours de l’effet anesthésique de l’infiltration ; réponse en aggravation, qui signe le plus souvent un contexte de sensibilisation pelvienne centrale.
Outre son intérêt diagnostique, l’effet thérapeutique de l’infiltration existe et n’est pas à négliger. Cet effet thérapeutique est à considérer lorsque la réduction du score EVA est supérieure ou égale à 50 % au-delà d’un mois. La fréquence de l’obtention de l’effet thérapeutique de l’infiltration pudendale est difficile à apprécier dans la littérature, mais pourrait atteindre 25 % à six mois, selon les auteurs.14 Dans ces situations, l’infiltration peut être répétée autant que nécessaire, dès constatation de la réduction de son effet thérapeutique. Les infiltrations d’anesthésiques locaux sont parfois diffusées en continu, à l’aide d’une pompe avec un cathéter péri-nerveux.
Chirurgie en deuxième ligne en cas de réponse positive au bloc-test
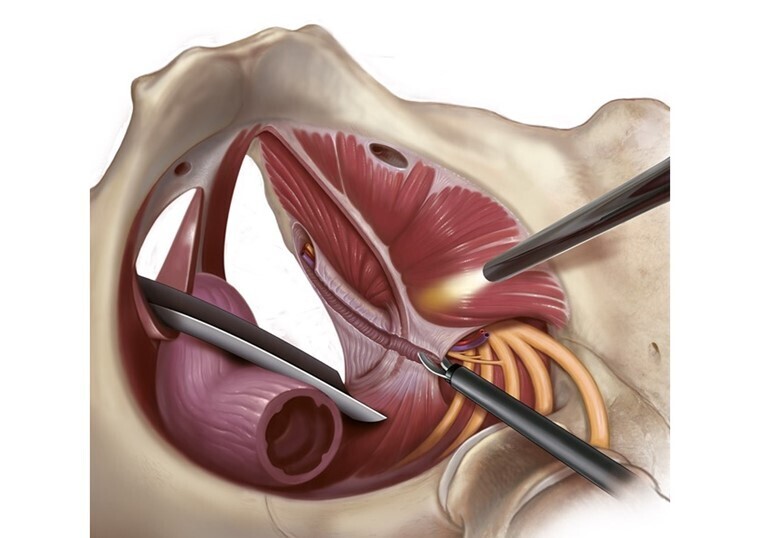
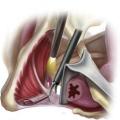
En cas d’échec de la première ligne thérapeutique et après réponse positive au bloc-test infiltratif, le consensus oriente vers l’indication chirurgicale de neurolyse-libération du nerf pudendal (fig. 5).4 La faible agressivité de la technique de neurolyse pudendale sous cœlioscopie et son faible taux de complications en font une opération de choix (fig. 6).
Cependant, plusieurs autres techniques de libération pudendale ont été décrites, avec des efficacités identiques : transglutéale,16 trans-ischiorectale par voie vaginale ou périnéale.17
Les résultats positifs sont importants : de 60 à 80 % des cas selon les auteurs. La technique opératoire dépend donc des habitudes chirurgicales et des antécédents du patient.
Une sélection rigoureuse des indications est cependant nécessaire, et les meilleurs résultats sont obtenus chez les patients présentant les critères de Nantes.15 Une réponse franche à l’infiltration, supérieure à vingt-quatre heures, voire un authentique effet thérapeutique transitoire, apparaissent comme un des meilleurs facteurs pronostiques favorables à l’intervention chirurgicale de libération du nerf pudendal.
À l’opposé, l’association à des critères d’hypersensibilisation pelvienne centrale est de mauvais pronostic, avec un risque d’aggravation postopératoire non négligeable.
Thérapeutiques non validées
La radiofréquence et la cryothérapie sont des thérapeutiques rapportées dans quelques études, avec un niveau de qualité médiocre.4 Elles ne sont donc actuellement pas validées, dans le traitement des névralgies pudendales. Il en est de même des injections de toxine botulinique en protocole neuropathique.18
Ces techniques ne sont envisagées qu’en troisième ligne, au cours de protocoles thérapeutiques, en centre d’expertise.
Que faire en situation d’échec thérapeutique ?
La neuromodulation et le cathéter périnerveux relié à une pompe à diffusion continue d’anesthésiques locaux sont envisagés en situation d’échec ou de récidive après la chirurgie.4,19,20
La stratégie proposée dépend de la persistance ou non de la réponse au test infiltratif aux anesthésiques locaux.
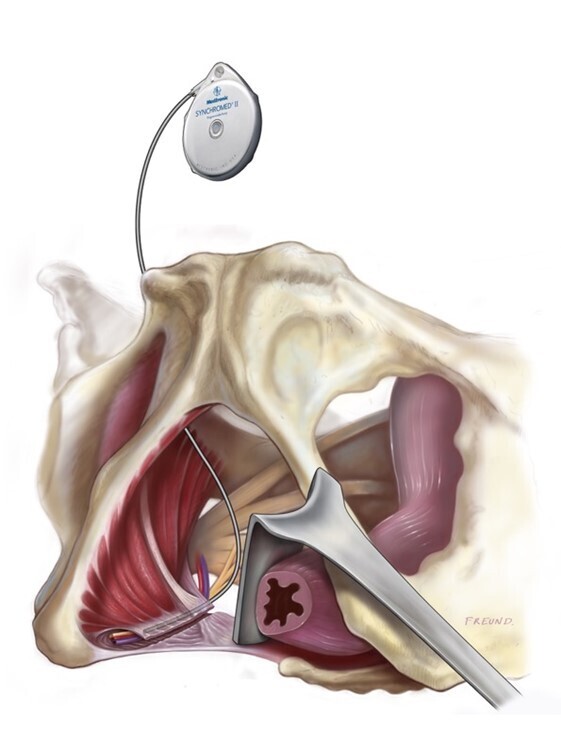
En présence d’une franche réponse au test infiltratif, l’implantation d’un cathéter périnerveux pudendal, autorisant la diffusion d’un anesthésique local en continu (ropivacaïne) par l’intermédiaire d’une pompe implantée, apporte les meilleurs résultats (fig. 7).20
En l’absence de réponse au test infiltratif, la neuromodulation est l’option thérapeutique à privilégier ; la neuromodulation du cône terminal semble apporter les meilleurs résultats, comparativement à la neuromodulation radiculaire ou tronculaire pudendale.17
Critères et recommandations pour optimiser la prise en charge
La connaissance des critères diagnostiques doit permettre d’éviter deux écueils encore très fréquents : sous-estimer ou porter par excès le diagnostic de névralgie pudendale.
Devant ce type de syndrome douloureux, une exploration pelvi-périnéale, idéalement une IRM, recherche une anomalie anatomique ou tumorale.
L’EMG ne doit plus être systématiquement proposé lorsqu’une névralgie pudendale est évoquée.
Rattacher la névralgie pudendale au syndrome de compression canalaire dit d’Alcock reste l’étape la plus difficile. Les critères cliniques de Nantes ainsi que la réponse à l’infiltration permettent d’orienter vers ce diagnostic.
Il existe aujourd’hui des recommandations pour la prise en charge de la névralgie pudendale par compression canalaire. Le consensus se fait sur l’introduction sans délai d’un traitement de la douleur chronique, de mesures d’évitement de la position assise traumatique, de rééducation périnéale et d’ostéopathie, de neurostimulation TENS, d’infiltration d’anesthésiques locaux.4
En cas d’échec de la première ligne thérapeutique, la chirurgie de libération-neurolyse est retenue, lorsque la réponse à l’infiltration est positive. Elle permet, en effet, des franches améliorations et guérisons. Les autres thérapeutiques comme la radiofréquence ou la cryoneurolyse ne bénéficient pas d’un niveau de preuve actuellement suffisant.
Critères de Nantes
Cinq critères cliniques plaident en faveur d’une névralgie pudendale par compression canalaire :
- 1. la douleur siège dans le territoire du nerf pudendal ;
- 2. la douleur prédomine en position assise ;
- 3. la douleur ne réveille pas la nuit ;
- 4. la douleur ne s’associe pas à un déficit neurologique sensitif ou moteur ;
- 5. il existe une réponse positive au bloc anesthésique (infiltration).
2. Scholz J, Finnerup NB, Attal N et al. The IASP classification of chronic pain for ICD-11: Chronic neuropathic pain. Pain 2019;160(1):53-9.
3. Labat JJ, Riant T, Robert R, et al. Diagnostic criteria for pudendal neuralgia by pudendal nerve entrapment (Nantes criteria). Neurourol Urodyn 2008;27(4):306-10.
4. Levesque A, Bautrant E, Quistrebert V, et al. Recommendations on the management of pudendal nerve entrapment syndrome: A formalized expert consensus. Eur J Pain 2022;26(1):7-17.
5. Lefaucheur JP, Labat JJ, Amarenco G, et al. What is the place of electroneuromyographic studies in the diagnostic and management of pudendal neuralgia related to entrapment syndrome? Neurophysiol Clin 2007;37(4):223-8.
6. Mollo M, Bautrant E, Rossi-Seignert AK, et al. Evaluation of diagnostic accuracy of colour duplex scanning, compared to electroneuromyography, diagnostic score and surgical outcomes, in pudendal neuralgia by entrapment: A prospective study on 96 patients. Pain 2009;142:159-63.
7. Sultan AH, Kamm MA, Hudson CN. Pudendal nerve damage during labour: Prospective study before and after childbirth. BJOG 1994;101:22-8.
8. Lien KC, Morgan DM, Delancey JOL, et al. Pudendal nerve stretch during vaginal birth: A 3D computer stimulation. Am J Obstet Gynecol 2005;192(5):1669-76.
9. Convergences PP Network. Pudendal nerve lesions after childbearing. Convergences PP annual congress. World Congress on Abdominal and Pelvic Pain (WCAPP5). Lyon, nov. 2021.
10. Convergences PP Network. Pudendal neuropathies of the elderly women. Convergences PP annual congress. Madrid, nov. 2019.
11. Amarenco G, Lanoe Y, Perrigot M, et al. A new canal syndrome: Compression of the pudendal nerve in Alcock’s canal or perineal paralysis of cyclists. Presse Med 1987;16(8):399.
12. Levesque A, Riant T, Ploteau S, et al. Clinical criteria of central sensitization in chronic pelvic pain and perineal pain (Convergences PP criteria): Elaboration of a clinical evaluation tool based on formal expert consensus. Pain Medecine 2018;19:2009-15.
13. Labat JJ, Riant T, Lassaux A, et al. Adding corticosteroids to the pudendal nerve block for pudendal neuralgia: A randomized, double blind, controlled trial. BJOG 2017;124(2):251-60.
14. Kastler A, Puget J, Tiberghien F, et al. Dual site pudendal nerve infiltration: More than just a diagnostic test? Pain Physician 2008;21(1):83-90.
15. Waxweiler C, Dobos S, Thill V, et al. Selection criteria for surgical treatment of pudendal neuralgia. Neurourology and Urodynamics 2017;36(3):663–6.
16. Robert R, Labat JJ, Bensignor M, et al. Decompression and transposition of the pudendal nerve in pudendal neuralgia: A randomized controlled trial and long-term evaluation. Eur Urol 2005;47:403-8.
17. Bautrant E. Que faire devant une névralgie pudendale ? Réalités en Gyn-Obstet 2010;148:23-6.
18. Attal N, de Andrade DC, Adam F, et al. Safety and efficacy of repeated injections of botulinic toxin A in peripheral neuropathioc pain (BOTNEP): A randomized, double blind, placebo-controlled trial. Lancet Neurol 2016;15(6):555-65.
19. Buffenoir B, Rioult B, Hamel O, et al. Spinal cord stimulation of the conus medullaris for refractory pudendal neuralgia: A prospective study of 27 consecutive cases. Neurourology and Urodynamics 2015;34(2):177-82.
20. Convergences PP Network. Peri-neural catheter connected to a programmable pump Synchromed II, for ropivacain continuous nerve diffusion in intractable pudendal neuralgias: Technic, indications and results. Convergences PP annual congress. World congress on Abdominal and Pelvic Pain (WCAPP5). Lyon, nov. 2021.

 Encadrés
Encadrés