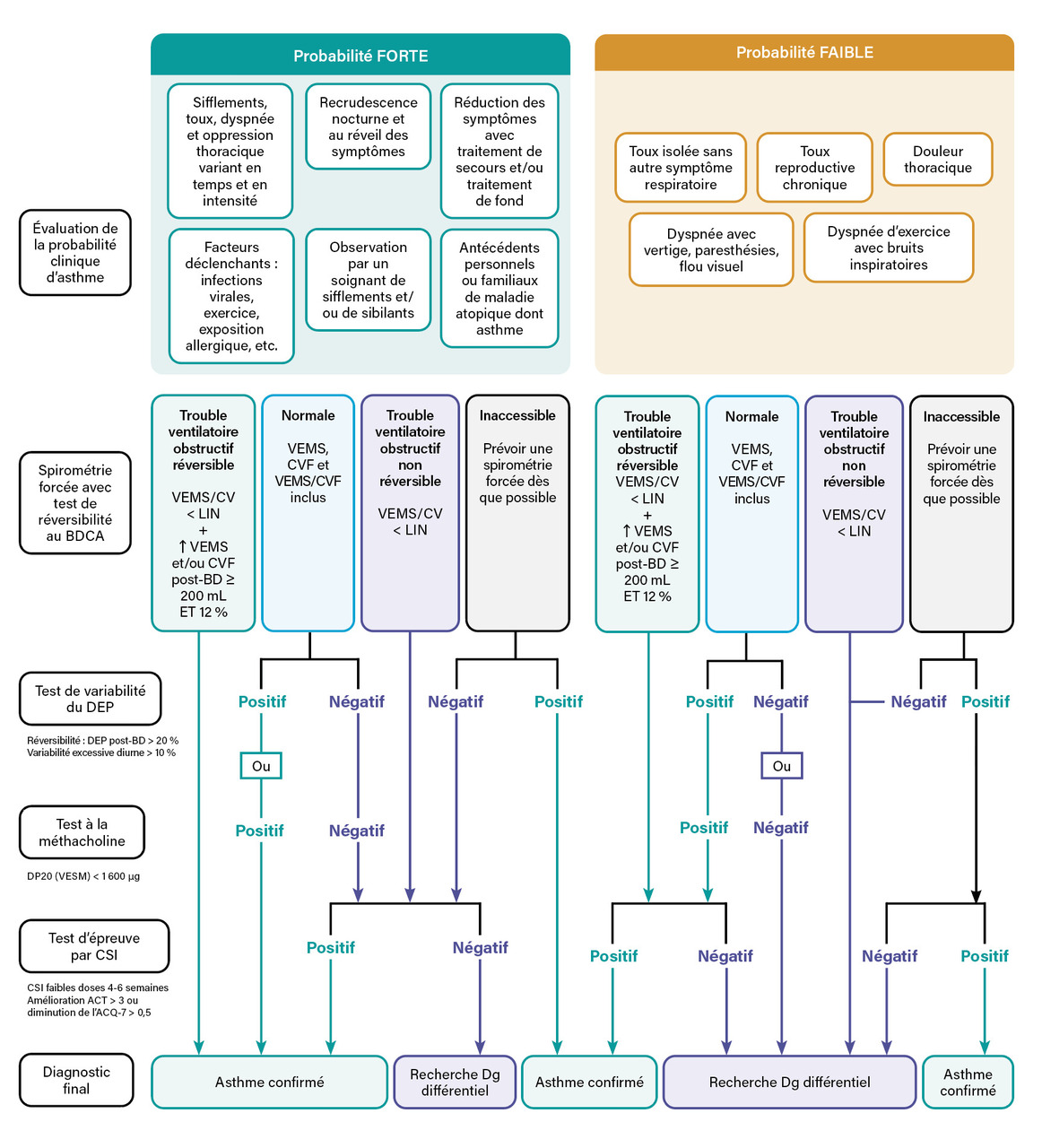
L’asthme est une pathologie chronique des voies aériennes caractérisée par la survenue de symptômes respiratoires compatibles, dans un contexte d’obstruction et d’inflammation bronchique, variables en intensité et dans le temps. En l’absence d’étalon-or diagnostique, plusieurs sociétés savantes en santé respiratoire (Société de pneumologie de langue française [SPLF], European Respiratory Society [ERS] et American Thoracic Society [ATS]) recommandent une approche bayésienne confrontant une probabilité clinique aux résultats d’examens complémentaires standardisés (fig. 1).1,2
Diagnostic positif de l’asthme
L’enquête diagnostique doit être menée avec rigueur afin de ne pas méconnaître d’éventuels diagnostics différentiels et comorbidités associées et/ou influant sur l’asthme.
Évaluation de la probabilité clinique de l’asthme
Aucun score de probabilité clinique n’a fait la preuve de sa pertinence dans le diagnostic de l’asthme. Les signes fonctionnels respiratoires rencontrés sont nombreux et peu spécifiques individuellement (dyspnée expiratoire d’effort ou de repos, de survenue paroxystique ou chronique, toux chronique, sifflements, oppression thoracique). L’interrogatoire s’attache à rechercher leur association, leur variabilité au cours du temps et en intensité mais aussi le ou les facteurs déclenchants (infections virales, expositions allergéniques, polluants atmosphériques, etc.). Une saisonnalité des symptômes (printemps-été) oriente vers l’hypothèse d’une allergie sous-jacente. Enfin, la recrudescence des symptômes la nuit et/ou le matin au réveil est évocatrice d’asthme.
L’examen physique du sujet asthmatique recherche un frein expiratoire et des râles sibilants à l’auscultation pulmonaire, témoin d’un bronchospasme sous-jacent. Toute autre anomalie auscultatoire (ronchis prédominants, wheezing, râles crépitants, asymétrie auscultatoire, etc.) amène à rechercher un diagnostic différentiel. L’examen physique est à confronter au tableau clinique (symptomatique ou non). En effet, une auscultation normale en période asymptomatique ne récuse pas le diagnostic d’asthme.
En fonction des présentations cliniques, de nombreux diagnostics différentiels sont possibles. Les plus fréquents sont rapportés dans le tableau. Certains de ces diagnostics peuvent être associés à l’asthme : trouble panique, dysfonction laryngée et syndrome d’hyperventilation. L’exploration diagnostique de la toux chronique fait l’objet de recommandations spécifiques.3 Enfin, concernant la population gériatrique (plus de 75 ans), il convient de prendre en compte la perception parfois altérée des symptômes respiratoires, notamment du bronchospasme, lors de l’enquête diagnostique clinique.4
Évaluation fonctionnelle respiratoire
L’évaluation fonctionnelle respiratoire est essentielle au diagnostic de l’asthme. Elle vise à prouver, d’une part, la limitation des débits expiratoires et, d’autre part, la variabilité de celle-ci.
La recherche d’une limitation des débits expiratoires est fondée sur la réalisation d’une spirométrie forcée qui met en évidence un trouble ventilatoire obstructif (TVO). Celui-ci se définit par un rapport volume expiré maximal en une seconde (VEMS) sur capacité vitale (CV) inférieur à la limite inférieure de la normale (LIN) des équations de la Global Lung Initiative (GLI).5 L’utilisation de la valeur maximale de la CV, déterminée entre la CV lente (CVL) et la CV forcée (CVF), permet de sensibiliser la recherche d’un TVO. La standardisation de la réalisation d’une spirométrie forcée fait l’objet de recommandations spécifiques émises par l’ERS et l’ATS.6 La mise en évidence d’une baisse significative de la CVF (inférieure à la LIN) doit faire l’objet d’investigations spécifiques pneumologiques (distinction restriction pulmonaire versus piégeage gazeux). Enfin, à l’instar de l’examen physique, l’interprétation de la spirométrie forcée tient compte des conditions de réalisation (phase symptomatique ou non).
La variabilité de la limitation des débits expiratoires, est quant à elle observable spontanément entre plusieurs spirométries forcées successives. Elle peut aussi être caractérisée sous traitement, au décours de la mise en place d’un traitement de fond par corticostéroïdes inhalés (lire l’article « Prise en charge de l’asthme de l’adulte », page 743). Enfin, la réalisation d’un test de réversibilité (ou réponse) au bronchodilatateur de courte durée d’action (BDCA) constitue une preuve de la variabilité des débits. Il consiste en la réalisation d’une spirométrie forcée, dix à quinze minutes après l’inhalation d’un BDCA (par exemple, 4 × 100 µg de salbutamol). Le test est jugé positif en cas d’amélioration du VEMS et/ou de la CVF de plus de 10 % de la valeur prédite selon le GLI. Il est recommandé de réaliser ce test de réversibilité lors du diagnostic initial, même en l’absence de trouble ventilatoire obstructif.
La variabilité du débit expiratoire de pointe (DEP) peut être recherchée, dans l’attente d’une spirométrie forcée lorsque celle-ci est indisponible ou normale et en l’absence de réversibilité significative. La démonstration au patient des modalités de réalisation est effectuée en consultation afin de limiter tout biais de mesure. La mesure des DEP se réalise matin et soir sur une durée d’une à deux semaines. La variabilité quotidienne se calcule par le rapport différence DEPmax-DEPmin sur la moyenne du DEP. Une variabilité quotidienne moyenne supérieure à 10 % constitue un argument en faveur d’un asthme. Il est utile, pour l’interprétation, de faire préciser l’existence concomitante ou non de symptômes. Par ailleurs, une augmentation du DEP de plus de 20 % après recours à un bronchodilatateur de courte durée d’action (2 à 4 bouffées de 100 µg de salbutamol) est compatible avec un asthme.
Une hyper-réactivité bronchique, cause de variabilité des débits expiratoires, est recherchée en cas de normalité de la spirométrie forcée.
Le test à la méthacholine est un test de provocation non spécifique visant à induire une réduction significative du VEMS (de 20 % ou plus) en réponse à des inhalations cumulées de bronchoconstricteurs (méthacholine).7 Le test est jugé positif lorsque la dose cumulée provoquant une baisse de 20 % du VEMS (DP20) est inférieure à 1 600 µg de méthacholine. Bien que sensible, la spécificité du test à la méthacholine est relativement basse, avec de nombreux faux positifs (autres pathologies bronchiques, sujets atopiques, etc.).
Réalisés en milieux spécialisés, les tests d’hyperventilation isocapnique et d’effort, à la recherche d’un bronchospasme, visent à objectiver respectivement une baisse significative du VEMS (supérieure ou égale à 10 %) en réponse à une hyperventilation et à un effort standardisé (ventilation minute supérieure à 60 % de la ventilation maximale théorique pendant six minutes).8 Ils sont notamment adaptés en cas de suspicion de bronchospasme induit par l’exercice.
Dans le cadre d’une approche bayésienne, l’importance de la variabilité des débits expiratoires module la probabilité post-test d’asthme. Celle-ci est d’autant plus probable que la variabilité spontanée du VEMS ou du DEP est importante, que l’augmentation du VEMS et/ou de la CVF après bronchodilatation est importante et que la DP20 de la méthacholine est basse.
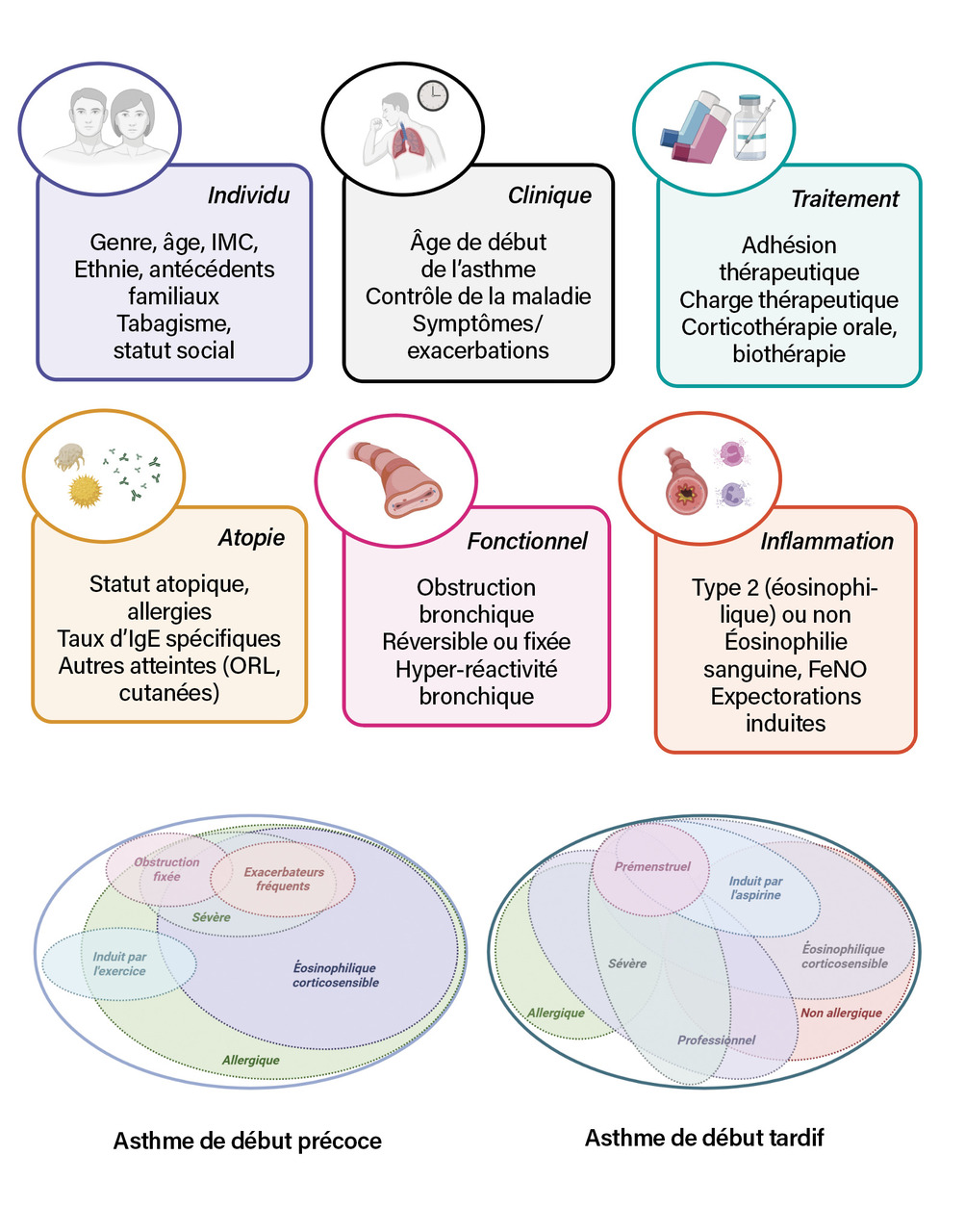
Phénotypes d’asthme les plus fréquents
Les présentations cliniques d’asthme rencontrées en pratique clinique sont hétérogènes (fig. 2).9,10 Près d’une centaine d’études menées sur des cohortes de patients asthmatiques adultes a été réalisée dans le but de constituer des groupes homogènes de patients.11 Malgré les limites inhérentes à ces études (hétérogénéité, choix des variables incluses, etc.), certaines caractéristiques phénotypiques sont plus fréquemment décrites comme signifiantes : âge de survenue de la maladie, atopie, atteintes rhinosinusiennes associées et obésité. Les phénotypes d’asthme de l’adulte les plus fréquents sont décrits ci-après.
Asthme allergique, le plus souvent
L’asthme allergique est un des phénotypes les plus fréquemment rencontrés chez l’adulte, avec une prévalence de la sensibilisation à un pneumallergène aux alentours de 60 à 80 % en fonction des études. L’asthme allergique se développe plus volontiers durant l’enfance et l’adolescence (début précoce). L’atopie, définie par la susceptibilité de l’individu à développer une réponse immunitaire adaptative médiée par les immunoglobulines E (IgE) à l’encontre d’un antigène, prédispose aux autres pathologies allergiques que sont la rhinoconjonctivite allergique, la dermatite atopique et l’allergie alimentaire.
Le diagnostic requiert une association causale entre les symptômes cliniques et l’exposition à des allergènes pour lesquels le sujet s’est sensibilisé.12
L’interrogatoire joue un rôle majeur dans l’identification des allergènes. La recherche d’une sensibilisation aux pneumallergènes est réalisée en première intention par des tests cutanés allergologiques (prick tests) ciblant les allergènes suspectés et prenant en compte les spécificités régionales (espèces polliniques). Le dosage des IgE spécifiques documente aussi une sensibilisation, en complément des prick tests ou lorsqu’ils ne sont pas réalisables. Compte tenu de la prévalence de l’allergie dans l’asthme et des impacts thérapeutiques majeurs (éviction allergénique), l’enquête allergologique doit être systématiquement réalisée chez tous les sujets asthmatiques.
Association à la polypose nasosinusienne
Apparaissant plutôt à l’âge adulte, l’asthme associé à la polypose nasosinusienne est le plus souvent éosinophilique et non allergique. Il s’agit de formes volontiers sévères avec une franche altération de la qualité de vie, des exacerbations d’asthme et de polypose fréquentes et un recours important à la corticothérapie systémique.
La recherche de symptômes ORL (score SNOT 22 : questionnaire simple recensant 22 symptômes) tels que la rhinorrhée chronique, l’obstruction nasale chronique et l’hyposmie/anosmie permet d’orienter le diagnostic.
La prise en charge de ces patients requiert une coordination entre le pneumologue et l’ORL afin d’optimiser le contrôle des deux maladies.13
Aggravation en cas d’association à l’obésité
L’asthme associé à l’obésité concerne principalement les sujets féminins à l’âge adulte. Ce phénotype d’asthme est souvent sévère, avec une qualité de vie significativement altérée par la symptomatologie liée à la fois à l’asthme et à l’obésité par elle-même (dyspnée d’effort).14
Sur le plan physiopathologique, l’inflammation bronchique, éosinophilique ou non, s’associe à des facteurs mécaniques, notamment de clôture précoce des petites voies aériennes.
La réduction pondéraleest un objectif important à fixer, car elle est associée à une amélioration significative des symptômes mais aussi du contrôle de l’asthme.
Endotypage requis en cas d’asthme sévère
La caractérisation du type inflammatoire bronchique (endotypage) est actuellement réalisée chez le patient asthmatique sévère pour guider la prise en charge (lire l’article « Biothérapies dans l’asthme de l’adulte », page 753).15 Elle comporte la recherche des biomarqueurs associés à l’inflammation de type 2 que sont l’éosinophilie sanguine, la fraction exhalée du monoxyde d’azote (lire le Focus « Place du test au NO exhalé dans le diagnostic et le suivi de l’asthme de l’adulte », page 741) et la quantification des IgE totales. Ces biomarqueurs permettent d’orienter la prescription des biothérapies lors des réunions de concertation d’asthme sévère.
Recherche systématique d’un asthme allergique
Le diagnostic d’asthme de l’adulte repose sur l’évaluation rigoureuse de la probabilité de la maladie, en s’appuyant sur la recherche de symptômes respiratoires évocateurs, variables dans le temps et en intensité.
Le principal examen complémentaire permettant d’étayer le diagnostic d’asthme est la spirométrie forcée avec test de réversibilité au BCDA, à la recherche d’un trouble ventilatoire obstructif réversible dont la définition est statistique (plus de seuil fixe).
De nombreuses présentations cliniques d’asthme sont possibles ; le phénotype allergique est de prévalence fréquente et sa prise en charge spécifique impose sa recherche systématique chez tous les patients asthmatiques.
2. Raherison-Semjen C, Guilleminault L, Billiart I, et al. Update of the 2021 recommendations for the management and follow-up of adult asthmatic patients under the guidance of the French Society of Pulmonology and the Paediatric Society of Pulmonology and Allergology. Long version. Rev Mal Respir 2021;38(10):1048-83.
3. Guilleminault L, Demoulin-Alexikova S, de Gabory L, et al. Guidelines for the management of chronic cough in adults. Endorsed by French speaking society of respiratory diseases (Societé de Pneumologie de Langue Francaise, SPLF), Societé Francaise d’Oto-Rhino-Laryngologie et de Chirurgie de la Face et du Cou (SFORL), Societé Francaise de Phoniatrie et de Laryngologie (SFPL), Societé Nationale Francaise de Gastro-entérologie (SNFGE). Respir Med Res 2023;83:101011.
4. Becker JH, Feldman JM, Arora A, et al. Cognition, symptom perception, and medication non-adherence in older adults with asthma. J Asthma 2022;59(3):607-15.
5. Gunther S, Gille T, Chenuel B, et al. Global Lung Initiative reference values are recommended for pulmonary function testing in France: A statement from the Lung Function Group of the French-Speaking Pulmonology Society. Rev Mal Respir 2023;40(2):198-201.
6. Graham BL, Steenbruggen I, Miller MR, et al. Standardization of spirometry 2019 update. An official American Thoracic Society and European Respiratory Society technical statement. Am J Respir Crit Care Med 2019;200(8):e70-e88.
7. Coates AL, Wanger J, Cockcroft DW, et al. ERS technical standard on bronchial challenge testing: General considerations and performance of methacholine challenge tests. European Respiratory Journal 2017;49(5):1601526.
8. Hallstrand TS, Leuppi JD, Joos G, et al. ERS technical standard on bronchial challenge testing: Pathophysiology and methodology of indirect airway challenge testing. Eur Respir J 2018;52(5):1801033.
9. Kaur R, Chupp G. Phenotypes and endotypes of adult asthma: Moving toward precision medicine. Journal of Allergy and Clinical Immunology 2019;144(1):1-12.
10. Wenzel SE. Asthma: Defining of the persistent adult phenotypes. Lancet 2006;368(9537):804-13.
11. Cunha F, Amaral R, Jacinto T, et al. A systematic review of asthma phenotypes derived by data-driven methods. Diagnostics (Basel) 2021;11(4):644.
12. Doyen V, Casset A, Divaret-Chauveau A, et al. Diagnosis of allergy in asthma. Rev Mal Respir 2020;37(3):243-56.
13. Bartier S, Coste A, Bequignon E. Management strategies for chronic rhinosinusitis with nasal polyps in adults. Rev Mal Respir 2021;38(2):183-98.
14. Villeneuve T, Guilleminault L. Asthma and obesity in adults. Rev Mal Respir 2020;37(1):60-74.
15. Holguin F, Cardet JC, Chung KF, et al. Management of severe asthma: A European Respiratory Society/American Thoracic Society guideline. Eur Respir J 2020;55(1):1900588.