La chirurgie est la pierre angulaire du traitement des sarcomes des tissus mous (STM). La survie globale des STM dépasse les 70 % à cinq ans ; elle est en amélioration constante d’année en année grâce à une meilleure prise en charge.1,2 La qualité de la chirurgie conditionne la survie globale en cas de sarcome tronculaire et la qualité de vie en cas de sarcome des membres. Il est absolument indispensable d’opérer avec un diagnostic précis posé sur une imagerie adaptée et, le plus souvent, une biopsie percutanée dont on aura attendu le résultat définitif. Ces éléments, associés au bilan d’extension, sont discutés en réunion de concertation pluridisciplinaire (RCP) afin de déterminer la meilleure stratégie thérapeutique.3 La chirurgie doit être réalisée par un chirurgien formé à cette spécialité en centre expert « sarcomes ».
Réfléchir avant d’opérer, avec un bilan préchirurgical adapté
Quelle que soit la localisation concernée, il a été montré que la survie globale est meilleure et la morbidité moindre lorsque le patient est opéré par un chirurgien spécialisé dans le domaine des sarcomes.4,5 Il est donc important de référer précocement le patient à un centre labellisé par l’Institut national du cancer (INCa) dans le domaine des sarcomes.
Sarcomes des membres
Au niveau des membres, le sarcome correspond à une masse souvent indolore, sauf si elle est située sur un nerf. L’ancienneté d’une tumeur ou son caractère superficiel ne sont pas garants de sa bénignité.3 Pour les petites tumeurs superficielles, une échographie peut permettre de vérifier si leur nature est purement graisseuse ou non et de préciser leur topographie par rapport aux aponévroses.6
Les tumeurs périphériques non graisseuses, volumineuses ou profondes relèvent d’une imagerie par résonance magnétique (IRM). L’imagerie des sarcomes n’est pas spécifique, et plusieurs diagnostics de tumeurs bénignes sont parfois évoqués à tort (lipome, schwannome, etc.). Des diagnostics éventuellement erronés, apportés en conclusion d’une échographie ou d’une IRM, peuvent engendrer des gestes chirurgicaux inadaptés, péjorant le pronostic du patient.
La biopsie percutanée est le plus souvent nécessaire pour confirmer le diagnostic avant de réaliser une intervention qui pourrait être inadaptée.3 En effet, opérer en sachant qu’il s’agit d’un sarcome permet une exérèse large d’emblée.
Sarcomes au niveau abdominal
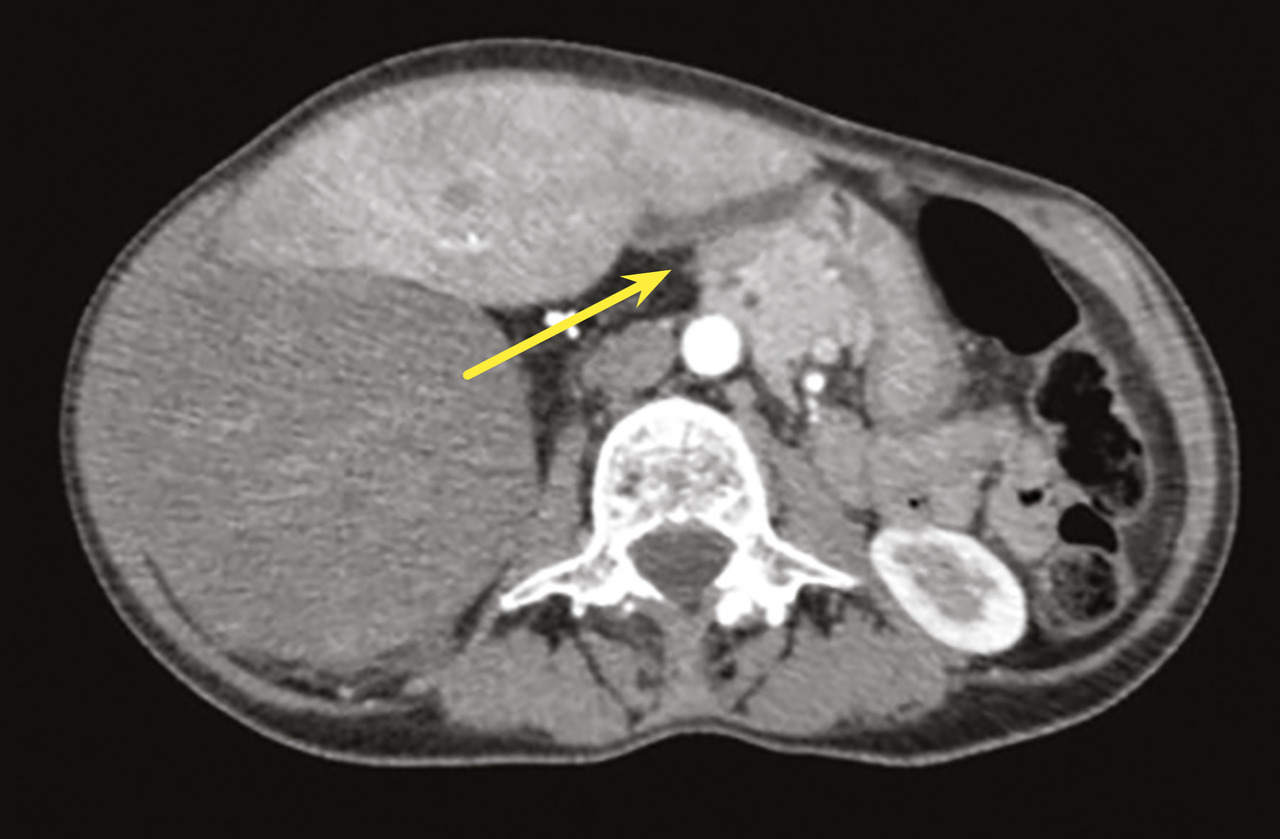
Au niveau abdominal, les signes sont fréquemment une augmentation du périmètre abdominal ou des troubles digestifs ; le patient s’est parfois mis au régime, avec pour conséquence une dénutrition, qui doit être dépistée avant la chirurgie.7 Le scanner abdominal est le premier examen à réaliser. Il convient d’être vigilant à l’égard de l’extension des tumeurs abdominales, en particulier rétropéritonéales, dans les défilés anatomiques (arcade crurale, trous de conjugaison, hiatus œsophagien), source de reliquats macroscopiques.8 De même, la composante bien différenciée (qui ressemble à de la graisse normale) d’un liposarcome rétropéritonéal est très souvent sous-estimée, ce qui peut engendrer des exérèses incomplètes, à l’insu d’un opérateur non spécialisé (fig. 1). Il est essentiel de considérer le déplacement des organes intra-abdominaux pour voir l’ensemble de la tumeur.9 Il est nécessaire de vérifier l’absence d’atteinte osseuse associée, qui modifie la classification diagnostique et donc les modalités thérapeutiques, notamment le choix du chirurgien expert.
Un diagnostic différentiel à connaître est celui des sarcomes du cordon spermatique, fréquemment confondus avec une « hernie inguinale » étranglée. Une « hernie inguinale » étranglée indolore et non réductible doit donc faire suspecter un sarcome et faire réaliser une imagerie adaptée.10
Biopsie percutanée
En dehors des tumeurs graisseuses bien différenciées, homogènes et superficielles de taille inférieure à 10 cm et en dehors des images bénignes pathognomoniques, la biopsie percutanée est réalisée pour confirmer (ou infirmer) le diagnostic.3,11,12 Le trajet de la biopsie est discuté entre le radiologue et le chirurgien. Des aiguilles coaxiales de 14 ou 16 gauges sont utilisées.3 Il faut attendre le résultat définitif car l’anatomopathologie nécessite l’utilisation de l’immunohistochimie et parfois de la biologie moléculaire : aucune décision de chirurgie large ne doit être prise sur un examen extemporané seul. Si le diagnostic de sarcome est confirmé, il est nécessaire de réaliser un bilan d’extension adapté afin de discuter la stratégie thérapeutique en RCP.
Technique chirurgicale des sarcomes périphériques (membres et paroi)
Le critère principal de la qualité de la chirurgie est qu’elle soit réalisée en un bloc avec des marges saines.3 Cela se traduit sur le compte-rendu anatomopathologique par la description d’une seule pièce opératoire (et non de plusieurs fragments) et par la quantification du tissu sain péritumoral. L’effraction de la tumeur contamine l’ensemble du foyer opératoire et expose aux poursuites évolutives plus ou moins rapides en fonction du grade de la tumeur. Faire une exérèse large, d’emblée à distance de la tumeur, suppose que l’on sait que l’on opère un sarcome grâce à la biopsie percutanée préopératoire, car il n’y a aucune raison de prendre des marges saines et donc du tissu sain si la lésion est bénigne. Un chirurgien qui opère sans diagnostic réalise donc une exérèse marginale, ce qui est insuffisant pour un sarcome.
Il n’y a pas de standard sur la quantité de tissu sain à retirer autour de la tumeur : cela dépend en particulier du sous-type de sarcome. Dans une étude rétrospective, tous sarcomes compris, la médiane de la marge minimum sur pièces fixées était de 2 mm (ce qui correspond à l’état frais à 0,5 cm de marge au minimum) avec un risque de rechute locale inférieur à 10 % à cinq ans, ce qui correspond à l’un des taux les plus faibles de la littérature.13 Aux extrêmes, un liposarcome bien différencié (tumeur adipeuse atypique) peut bénéficier d’une exérèse extracapsulaire avec peu de marges, alors qu’à l’inverse il est nécessaire de prendre des marges importantes pour un myxofibrosarcome ou un sarcome mal limité (sarcome épithélioïde, par exemple).3 Il faut alors opérer sans voir la tumeur, en passant d’emblée à distance en s’aidant de l’IRM. Il ne faut pas la disséquer et faire ensuite des recoupes, car le foyer opératoire a été contaminé même si les recoupes sont saines. Passer à distance du sarcome suppose que les structures anatomiques nobles, comme les vaisseaux et les nerfs, soient repérées, ce qui impose le plus fréquemment une incision dans l’axe du membre. Dans certains cas, afin de préserver une structure noble comme un vaisseau ou un nerf majeur, la décision peut être prise de réaliser une exérèse marginale programmée le long de la structure à conserver ; cela n’est possible que si cette dernière n’est pas incluse dans le sarcome mais en est juste adjacente.14
Toutes les reconstructions nécessaires doivent avoir été anticipées, en particulier les reconstructions par lambeau, de façon à couvrir un espace mort important, les vaisseaux ou l’os. Le choix du lambeau doit être discuté avec le chirurgien plasticien avant l’intervention. Il ne faut pas fermer la peau directement sur l’os, un pontage vasculaire ou des vaisseaux.15 De même, si des vaisseaux sont inclus dans le sarcome, il faut envisager un pontage vasculaire effectué par un chirurgien vasculaire qui a examiné le patient avant l’intervention.16 L’amputation est rarement nécessaire (moins de 5 % des cas dans les séries récentes), réservée aux situations très évoluées dans des localisations où un traitement conservateur ne serait pas fonctionnel, d’autant que celle-ci ne modifie pas la survie globale.3 La pièce opératoire est envoyée orientée à l’anatomopathologiste. Les drainages sont placés dans l’axe de la cicatrice et vers le bas, de façon à pouvoir être repris facilement et ne pas reporter plus haut une amputation éventuelle en cas de rechute.
Avec une chirurgie adaptée, tous sous-types de sarcomes compris, le risque de rechute locale est inférieur à 10 % à cinq ans pour les membres et la survie globale de l’ordre de 75 % à cinq ans, avec de grandes différences en fonction des sous-types histologiques.1,13
Devant une exérèse inadaptée ou non planifiée, en particulier lorsqu’il y a une effraction tumorale, une reprise d’exérèse élargie doit être proposée.3 Il faut se référer au compte-rendu opératoire et à l’examen macroscopique de l’anatomopathologie initiale (et non à la relecture, qui ne concerne qu’un bloc transféré et ne renseigne que sur le sous-type histologique et le grade).
Après énucléation simple sans effraction tumorale, et en l’absence de reliquat macroscopique peuvent se discuter, dans certains cas, une surveillance simple et une réintervention en cas de rechute locale documentée. Cette stratégie est néanmoins à discuter en centre expert.17
La chirurgie des rechutes locales impose fréquemment des reconstructions par lambeau lorsqu’elles surviennent en territoire irradié.15
Technique d’exérèse des sarcomes abdominaux
Les sarcomes intra-abdominaux peuvent être de deux types :
- rétropéritonéaux ; ce sont des STM situés en arrière du péritoine ;
- viscéraux, qui dépendent de la paroi d’un viscère intra- ou rétropéritonéal.8
Sarcome abdominal rétropéritonéal
Devant une tumeur rétropéritonéale, comme pour les sarcomes de membres, il est absolument nécessaire d’avoir un diagnostic de certitude avant d’opérer et, dans la majorité des cas, de faire une biopsie percutanée, sauf si des marqueurs tumoraux peuvent confirmer le diagnostic (tumeur germinale, paragangliome, etc.).7
Les critères de qualité de la chirurgie des sarcomes rétropéritonéaux sont d’une part une exérèse en un bloc et d’autre part des marges saines sur la plus grande superficie (fig. 2).11 Il ne faut pas faire de biopsie chirurgicale par cœlioscopie ou laparotomie car cela correspond à une effraction tumorale.8,11 Si le patient a été opéré d’emblée sur un diagnostic erroné de tumeur intrapéritonéale (sur une hypothèse de tumeur de l’ovaire, par exemple) et que l’on constate que la tumeur est rétropéritonéale, il vaut mieux refermer et prévoir une biopsie percutanée par voie rétropéritonéale ensuite. Après une exérèse fragmentaire, le patient est exposé à un essaimage péritonéal plus ou moins rapide selon le grade, et une reprise chirurgicale ne modifie pas ce risque.
Deux grandes études ont montré qu’une chirurgie dite « compartimententale » permet de diminuer d’un facteur trois le risque de rechute locale et d’améliorer la survie globale par rapport à une excision simple de la tumeur.18,19 Cette chirurgie compartimentale consiste à réséquer la tumeur avec ce qui est inclus à l’intérieur (le rein le plus souvent), en avant (le côlon et son méso) et en arrière (les aponévroses musculaires), pour optimiser les marges.8,11,20 Les structures nobles (vaisseaux et nerfs) ne sont pas réséquées si elles ne sont pas incluses dans la tumeur ou infiltrées. La chirurgie compartimentale s’applique plus particulièrement aux liposarcomes, dont le risque évolutif est essentiellement la rechute locale et dont la répétition finit par entraîner le décès du patient. En revanche, les léiomyosarcomes sont surtout exposés à un risque métastatique élevé alors que le risque de rechute locale est faible. En conséquence, leur chirurgie est plus limitée et consiste en une exérèse simple de la tumeur et de ce qu’elle infiltre directement. De même, les tumeurs rétropéritonéales à risque de rechute locale faible comme les tumeurs fibreuses solitaires ou les tumeurs malignes des gaines nerveuses périphériques peuvent bénéficier d’une exérèse simple.21
Bien entendu, il est nécessaire d’adapter la technique à l’âge, aux comorbidités du patient et à son état nutritionnel.22
Après chirurgie compartimentale d’un sarcome rétropéritonéal, le risque de rechute locale à cinq ans est de l’ordre de 25 % et la survie globale à cinq ans de l’ordre de 70 %.18,19,23 Il a été montré dans une étude française que la survie globale est meilleure lorsque le patient a été opéré dans un centre spécialisé en sarcomes.5
Sarcome viscéral
La chirurgie des sarcomes viscéraux est plus simple car le problème des marges se pose essentiellement sur le viscère concerné.8 Contrairement à d’autres tumeurs comme les carcinomes, il est difficile de préciser une quantité de marge idéale, car elle dépend du sous-type du sarcome et de l’organe considéré. Par accord d’expert, des marges arbitrairement plus importantes sont prises pour les sarcomes mal limités. L’objectif chirurgical est d’être le plus conservateur possible, en particulier sur des organes comme la vessie. Il faut trouver un compromis entre la qualité des marges – il faut une marge saine – et le caractère fonctionnel de la chirurgie. Un examen extemporané sur les berges peut aider à vérifier leur intégrité. Il n’y a pas d’indication à réséquer des organes adjacents, sauf si leur libération peut entraîner une effraction tumorale ou s’ils sont infiltrés. Des résections segmentaires ou partielles d’organes peuvent donc être effectuées.
S’il s’agit d’une tumeur stromale gastro-intestinale localement évoluée ou à proximité du sphincter anal, et que la mutation est sensible, l’indication d’un traitement par imatinib en néoadjuvant est discutée en RCP.
Traitements locorégionaux des métastases
Les traitements locorégionaux des métastases peuvent être indiqués soit à visée potentiellement « curatrice » chez les patients oligométastatiques, en particulier lorsque le délai de leur apparition est supérieur à un an, soit à visée symptomatique lorsque la métastase entraîne une gêne fonctionnelle, par exemple une métastase rachidienne compressive.3,23 Selon la localisation tumorale, l’âge et les comorbidités du patient, les différentes techniques ablatives sont envisagées : chirurgie, radiofréquence ou cryothérapie, radiothérapie stéréotaxique. L’indication de traitement et le choix de la technique sont discutés en RCP.24
Complications et séquelles
Toutes les études ont montré que les complications sont moins nombreuses lorsque la chirurgie est effectuée dans un centre expert en sarcomes.
Au niveau de l’abdomen, le taux de complications sérieuses avec la chirurgie multiviscérale est inférieur à 20 %. La dénutrition éventuelle des patients, leur état général et certains organes à réséquer lorsqu’ils sont infiltrés (pancréas, vaisseaux) sont des paramètres essentiels du risque de complication.22
Au niveau des membres, la radiothérapie préopératoire majore le risque de complications postopératoires (avec une fréquence de complications grade 3 de l’ordre de 30 %), mais il existe moins de complications à long terme par rapport au postopératoire car les champs sont plus limités et la dose plus faible.25 Néanmoins, chez des patients âgés ou dans certaines localisations, on peut privilégier le postopératoire. Les séquelles dépendent des exérèses musculaires et nerveuses, mais sont finalement relativement modérées comparativement à la chirurgie effectuée. Par ailleurs, les patients peuvent présenter un lymphœdème, en particulier après exérèse des sarcomes des adducteurs. Ce lymphœdème est la conséquence du cumul de la chirurgie et de la radiothérapie.
Pour les sarcomes rétropéritonéaux, l’accent est mis sur la surveillance de la fonction rénale en raison de la néphrectomie fréquente.
Pour les liposarcomes, dont le risque de métastases hépatiques est très faible, sont privilégiés des scanners de surveillance sans injection, qui permettent de dépister une rechute intra-abdominale afin de limiter les injections de produit de contraste dont la répétition peut favoriser l’altération de la fonction rénale résiduelle.
Surveillance adaptée au risque de rechute
Il n’y a pas d’étude prospective validant un schéma de surveillance ; les recommandations correspondent à des accords d’experts.3,11 En pratique, on adapte la périodicité des contrôles au risque des rechutes, et en particulier au grade de la tumeur.
Globalement, pour les sarcomes de bas grade, une surveillance tous les six mois pendant cinq ans puis annuellement est suffisante.3
Pour les sarcomes de haut grade, une surveillance plus rapprochée pendant les deux premières années (tous les quatre mois) est admise.
La durée totale de surveillance n’est pas validée par des études, mais des rechutes tardives peuvent être observées, en particulier pour les sarcomes de bas grade. Une durée de surveillance de l’ordre de dix ans est donc préconisée.
Chirurgie hautement spécialisée
La chirurgie des sarcomes est très spécifique et, quelle que soit la localisation, la survie globale est meilleure et la morbidité moindre lorsque le geste est effectué par un chirurgien entraîné à cette spécialité. Il est donc essentiel de référer le patient, dès la suspicion de sarcome, à un centre labellisé par l’INCa dans le domaine des sarcomes.
2. Blay JY, Penel N, Valentin T, et al. Improved nationwide survival of sarcoma patients with a network of reference centers. Ann Oncol 2024: S0923-7534(24)00008-5.
3. Gronchi A, Miah AB, Dei Tos AP, et al. Soft tissue and visceral sarcomas: ESMO-EURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2021;32(11):1348-65.
4. Blay JY, Honore C, Stoeckle E, et al. Surgery in reference centers improves survival of sarcoma patients: A nationwide study. Ann Oncol 2019;30(8):1407.
5. Bonvalot S, Gaignard E, Stoeckle E, et al. Survival benefit of the surgical management of retroperitoneal sarcoma in a reference center: A nationwide study of the French Sarcoma Group from the NetSarc Database. Ann Surg Oncol 2019;26(7):2286-93.
6. Moulin B, Messiou C, Crombe A, et al. Diagnosis strategy of adipocytic soft-tissue tumors in adults: A consensus from European experts. Eur J Surg Oncol 2022;48(3):518-25.
7. Bonvalot S, Lae M, Tzanis D, et al. Tumeurs rétro-péritonéales primitives de l’adulte. EMC Urologie 2019;12(1):1-8 article 18-083-A-10.
8. Bonvalot S, Tzanis D, Bouhadiba T, et al. Prise en charge chirurgicale des sarcomes abdominaux. EMC Techniques chirurgicales. Appareil digestif 2019 0(0):1-11. Article 40-087.
9. Messiou C, Moskovic E, Vanel D, et al. Primary retroperitoneal soft tissue sarcoma: Imaging appearances, pitfalls and diagnostic algorithm. Eur J Surg Oncol 2017;43(7):1191-8.
10. Achard G, Charon-Barra C, Carrere S, et al. Prognostic factors and outcomes of adult spermatic cord sarcoma. A study from the French Sarcoma Group. Eur J Surg Oncol 2023;49(7):1203-8.
11. Swallow CJ, Strauss DC, Bonvalot S, et al. Management of primary retroperitoneal sarcoma (RPS) in the adult: An updated consensus approach from the transatlantic Australasian RPS working group. Ann Surg Oncol 2021;28(12):7873-88.
12. Nardi W, Nicolas N, El Zein S, et al. Diagnostic accuracy and safety of percutaneous core needle biopsy of retroperitoneal tumours. Eur J Surg Oncol 2024;50(1):107298.
13. Bonvalot S, Levy A, Terrier P, et al. Primary extremity soft tissue sarcomas: Does local control impact survival? Ann Surg Oncol 2017;24(1):194-201.
14. Bonvalot S, Missenard G, Brisse H, et al. Principes du traitement chirurgical des sarcomes des tissus mous des membres et du tronc de l’adulte. EMC Appareil locomoteur 2023;37(3):1-11. Article 14-806.
15. Samà L, Binder JP, Darrigues L, et al. Safe-margin surgery by plastic reconstruction in extremities or parietal trunk soft tissue sarcoma: A tertiary single centre experience. Eur J Surg Oncol 2022;48(3):526-32.
16. Hauguel A, Goueffic Y, Tzanis D, et al. Arterial reconstruction for en-bloc resection of soft tissue sarcoma: A single tertiary center experience. Ann Vasc Surg 2023;93:29-37.
17. Decanter G, Stoeckle E, Honore C, et al. Watch and wait approach for re-excision after unplanned yet macroscopically complete excision of extremity and superficial truncal soft tissue sarcoma is safe and does not affect metastatic risk or amputation rate. Ann Surg Oncol 2019;26(11):3526-34.
18. Bonvalot S, Rivoire M, Castaing M, et al. Primary retroperitoneal sarcomas: A multivariate analysis of surgical factors associated with local control. J Clin Oncol 2009;27(1):31-7.
19. Gronchi A, Miceli R, Colombo C, et al. Frontline extended surgery is associated with improved survival in retroperitoneal low to intermediate-grade soft tissue sarcomas. Ann Oncol 2012;23(4):1067-73.
20. Bonvalot S, Raut CP, Pollock RE, et al. Technical considerations in surgery for retroperitoneal sarcomas: Position paper from E-Surge, a master class in sarcoma surgery, and EORTC-STBSG. Ann Surg Oncol 2012;19(9):2981-91.
21. Bonvalot S, Roland C, Raut C, et al. Histology-tailored multidisciplinary management of primary retroperitoneal sarcomas. Eur J Surg Oncol 2023;49(6):1061-7.
22. Di Prata C, Renouf B, Tzanis D, et al. Significant predictors of postoperative morbidity after radical resection of retroperitoneal sarcoma in a tertiary center. Ann Surg Oncol 2023;30(7):4515-26.
23. Gronchi A, Strauss DC, Miceli R, et al. Variability in patterns of recurrence after resection of primary retroperitoneal sarcoma (RPS): A report on 1007 patients from the Multi-institutional Collaborative RPS Working Group. Ann Surg 2016;263:1002-9.
24. Bonvalot S, Tetreau R, Llacer-Moscardo C, et al. The landmark series: Multimodal management of oligometastatic sarcoma. Ann Surg Oncol 2024, in press.
25. O’Sullivan B, Davis AM, Turcotte R, et al. Preoperative versus postoperative radiotherapy in soft-tissue sarcoma of the limbs: A randomised trial. Lancet 2002;359:2235e41.
Dans cet article
- Réfléchir avant d’opérer, avec un bilan préchirurgical adapté
- Technique chirurgicale des sarcomes périphériques (membres et paroi)
- Technique d’exérèse des sarcomes abdominaux
- Traitements locorégionaux des métastases
- Complications et séquelles
- Surveillance adaptée au risque de rechute
- Chirurgie hautement spécialisée