L’essor des analogues du GLP- 1 (aGLP- 1) redéfinit en profondeur le traitement médicamenteux de l’obésité. Tandis que les recos européennes et de l’OMS de 2025 leur accordent désormais une place, la HAS a rendu en fin d’année un avis favorable au remboursement de Wegovy (sémaglutide) et de Mounjaro (tirzépatide) dans l’obésité, et l’ANSM vient de confirmer leur rapport bénéfice/risque favorable dans le traitement de l’obésité suivant leurs AMM.
En parallèle, les industriels avancent dans la quête chimiquement ardue d’aGLP- 1 oraux, plus faciles d’utilisation. Une première formulation per os de Wegovy par Novo Nordisk est approuvée depuis fin décembre 2025 sur le marché américain, et un récent essai de phase 3 s’est révélé concluant pour l’orforglipron, nouvel aGLP- 1 oral d’Eli Lilly.
La recherche internationale progresse aussi sur les triples agonistes des récepteurs du GLP- 1, du GIP et du glucagon (rétatrutide par l’américain Eli Lilly [premiers résultats en phase 3 annoncés mi-décembre par l’entreprise ; perte de poids de 28,7 % à 68 semaines de traitement dans le bras à 12 mg/semaine], éfocipegtrutide par le sud-coréen Hanmi en phase 2, UBT251 par le danois Novo Nordisk en phase 2). Ces avancées suscitent l’espoir dedisposer de molécules encore plus efficaces.
Enfin, les entreprises chinoises se lancent aussi dans la course à l’innovation, ce qui pourrait mener à terme tous les producteurs d’aGLP- 1 à baisser leurs prix et ainsi les rendre plus accessibles.
Malgré ces éléments positifs, l’engouement pour ces molécules questionne : en situation d’obésité, qui peut en bénéficier ? Quel aGLP- 1 prescrire, et dans quel cadre ? Quels sont les risques et les contre-indications ? Quel parcours de soins pour les patients, et quid de l’arrêt de ces molécules, associé à une reprise rapide de poids ?
Le Groupe de concertation et de coordination des centres spécialisés de l’obésité (GCC-CSO), soutenu par l’Association française d’études et de recherche sur l’obésité (AFERO) et la Société française et francophone de chirurgie de l’obésité et des maladies métaboliques (SOFFCO-MM), a publié le 5 décembre 2025 un référentiel sur les nouveaux traitements médicamenteux de l’obésité (TMO) disponibles chez l’adulte (liraglutide, sémaglutide et tirzépatide lors de sa rédaction en 2025). En tout, 45 préconisations ont été émises par un groupe de travail pluridisciplinaire de 12 experts. Qu’en retenir pour la pratique ?
Indications et CI
Selon leurs AMM, les TMO sont indiqués pour le contrôle du poids, en complément d’un régime hypocalorique et d’une augmentation de l’activité physique, chez les adultes :
- ayant un IMC ≥ 30 ;
- ayant un surpoids (27 ≤ IMC < 30) associé à au moins une comorbidité liée au poids (prédiabète ou DT2, HTA, dyslipidémie, SAOS ou maladie CV).
Les auteurs rappellent que les TMO sont indiqués endeuxième intention, chez des patients ayant déjà bénéficié d’une prise en chargenutritionnelle, comportementale et en activité physiquesur une durée de 6 mois et n’ayant pas atteint ses objectifs.
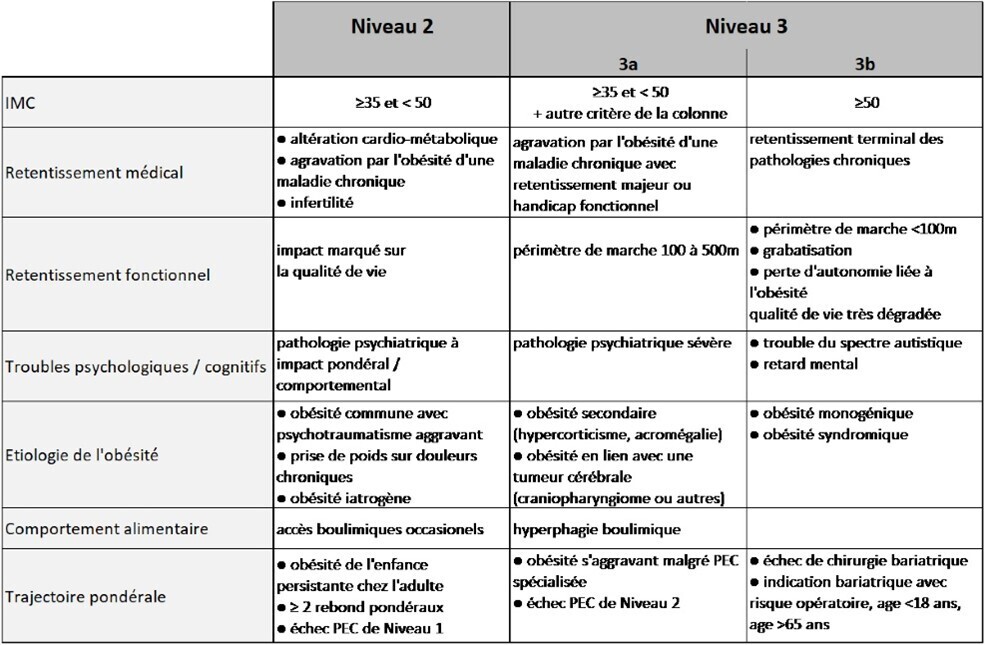
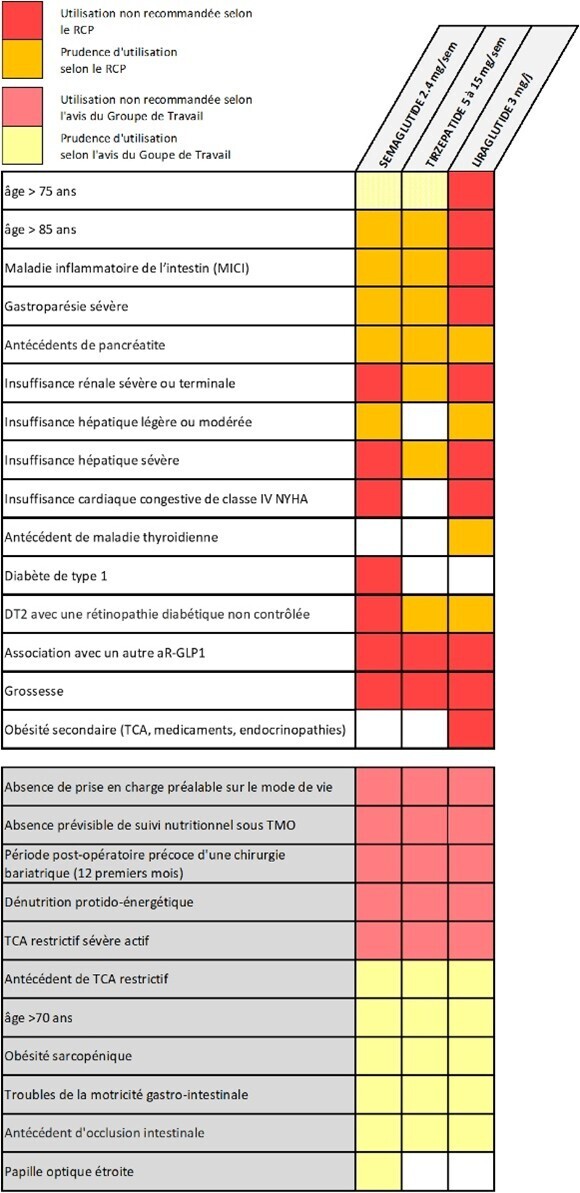
Introduire un TMO doit se faire dans le cadre d’une décision médicale partagée sous la responsabilité du médecin prescripteur, qui doit en assurer le suivi régulier et l’accompagnement par un professionnel compétent en nutrition, qu’il s’agisse de lui-même ou d’un diététicien/médecin nutritionniste. La décision ne prend pas uniquement en compte la gestion du poids, mais également les complications de l’obésité et la qualité de vie. Les TMO sont à privilégier chez les patients atteints d’obésité de niveau 2 ou 3 selon la HAS(cf. figure 1). La figure 2 résume les indications non recommandées et les précautions d’emploi.
Posologie et modalités d’administration
La posologie et le choix du TMO doivent être personnalisés en fonction des objectifs de réduction pondérale, d’amélioration des complications de l’obésité et de la qualité de vie (sans dépasser les posologies maximales de l’AMM).
Les schémas d’augmentation de dose sont indiqués en tableau 1. Ces protocoles doivent bien sûr s’adapter à la tolérance digestive du patient et à la perte de poids.
Comme nous l’indiquions dans un précédent article, ces médicaments peuvent être administrés uniquement par injection sous-cutanée dans l’abdomen, la cuisse ou le haut du bras. La dose peut être donnée à toute heure de la journée, au moment ou en dehors des repas. Il est recommandé d’alterner les sites à chaque injection.
Traitement au long cours
Il convient d’informer le patient que la perte de poids induite par un TMO suit 2 phases :
- la réduction pondérale, qui s’étale sur environ 12 mois (certains patients peuvent atteindre le plateau pondéral plus précocement) ;
- la phase de stabilisation (plateau pondéral) sous traitement.
Le maintien d’un TMO au plateau pondéral (à la dose ayant permis de l’atteindre) permet habituellement de maintenir la perte de poids (recul de 3 - 4 ans sur ces affirmations). Il n’y a pas de données permettant de proposer une adaptation du TMO (changement de dose, de molécule, de fréquence d’administration) une fois le plateau atteint.
L’arrêt d’un TMO s’accompagne le plus souvent d’une reprise pondérale significative , de l’ordre de 70 % du poids perdu au cours de l’année suivant l’arrêt. Dans ce contexte, les spécialistes recommandent de maintenir le traitement sur le long terme, avec une réévaluation régulière, à la dose ayant permis d’atteindre le plateau.
Le patient doit être informé dès la mise en place du TMO que ce traitement est à envisager sur le long cours. En cas d’arrêt, il est essentiel de prévoir un suivi rapproché et un relais par des stratégies durables : renforcement des habitudes alimentaires saines, intensification de l’activité physique, soutien psychologique et comportemental, prise en charge des comorbidités psychiatriques, voire chirurgie bariatrique.
Suivi : attention à 3 situations cliniques
Le groupe de travail recommande au prescripteur de suivre régulièrement l’évolution pondérale sous TMO, notamment 3, 6 et 12 mois après l’introduction. Une checklist de visite de suivi est proposée dans le tableau 2. Trois situations imposent une attention particulière : non réponse précoce, réponse pondérale insuffisante au plateau, perte de poids trop rapide. La stratégie à adopter dans chaque cas de figure est résumée dans le tableau 3.
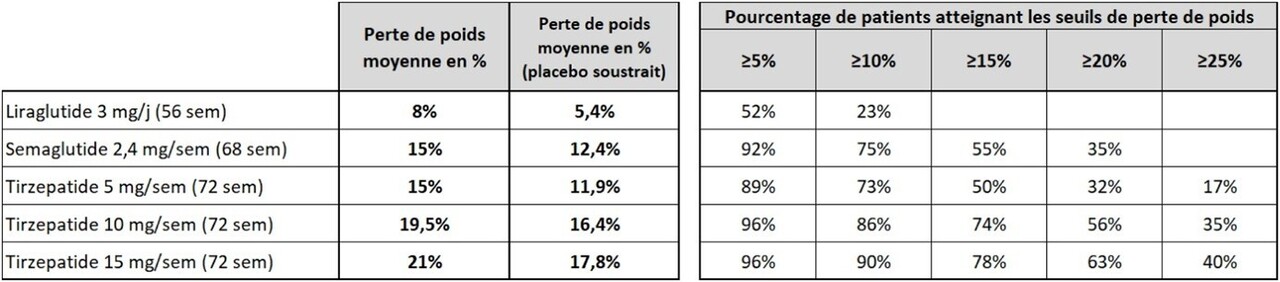
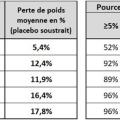
Les TMO disponibles en France diffèrent en termes d’efficacité prouvée sur les différentes complications de l’obésité (voir plus bas), et en perte de poids moyenne attendue (voir figure 3). La perte de poids est généralement moins importante en cas de DT2, et plus marquée chez les femmes que chez les hommes.
Une bonne réponse pondérale précoce, c’est-à-dire une perte de poids ≥ 5 % entre la 12e et la 20e semaine, est un facteur prédictif de meilleure réponse au plateau.
Enfin, l’inefficacité pondérale des TMO est définie comme une absence de perte de poids significative (< 5 %) après traitement d’un an à la dose maximale tolérée. Dans les essais randomisés de référence pour les 3 molécules disponibles, les taux d’inefficacité sont respectivement de 48,2 % sous liraglutide 3 mg/j, 7,6 % sous sémaglutide 2,4 mg/semaine et 3,7 % sous tirzépatide 15 mg/semaine.
Complications de l’obésité : quel TMO privilégier ?
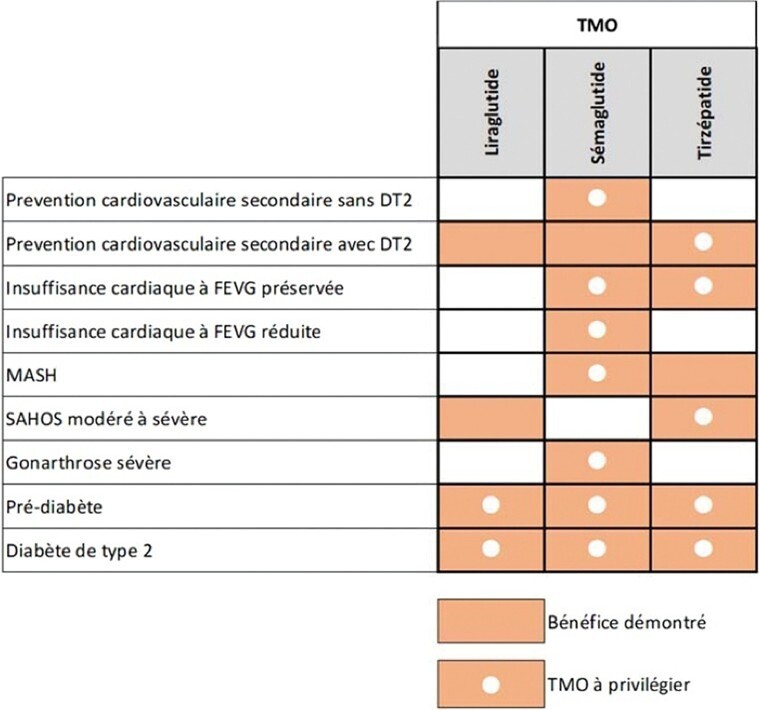
Le groupe de travail propose de privilégier la prescription de certains TMO en fonction du phénotype du patient (insuffisance cardiaque, MASH, diabète de type 2, etc.), afin de traiter les complications de l’obésité. Ces recommandations, basées sur l’état des connaissances en 2025 et donc susceptibles d’évoluer, sont résumées dans la figure 4.
Grossesse et allaitement
En complément des précautions d’emploi listées en figure 2, ces médicaments ne doivent pas être utilisés en cas de grossesse et pendant l’allaitement. Les auteurs recommandent, chez toute femme en âge de procréer traitée par TMO, de prescrire une méthode de contraception efficace (hormonale, mécanique). Si la femme y est favorable, une contraception de longue durée (DIU ou implants) devrait être privilégiée.
En cas de projet de grossesse, les TMO doivent être arrêtés avant l’arrêt de la contraception, ou avant un transfert d’embryon en cas de fécondation in vitro, dans les délais suivants :
- 1 semaine pour le liraglutide ;
- 2 mois pour le sémaglutide ;
- 1 mois pour le tirzépatide.
En cas de grossesse débutée sous TMO, le TMO doit être arrêté dès le diagnostic. Les données actuelles sont insuffisantes pour recommander une interruption médicale de grossesse.
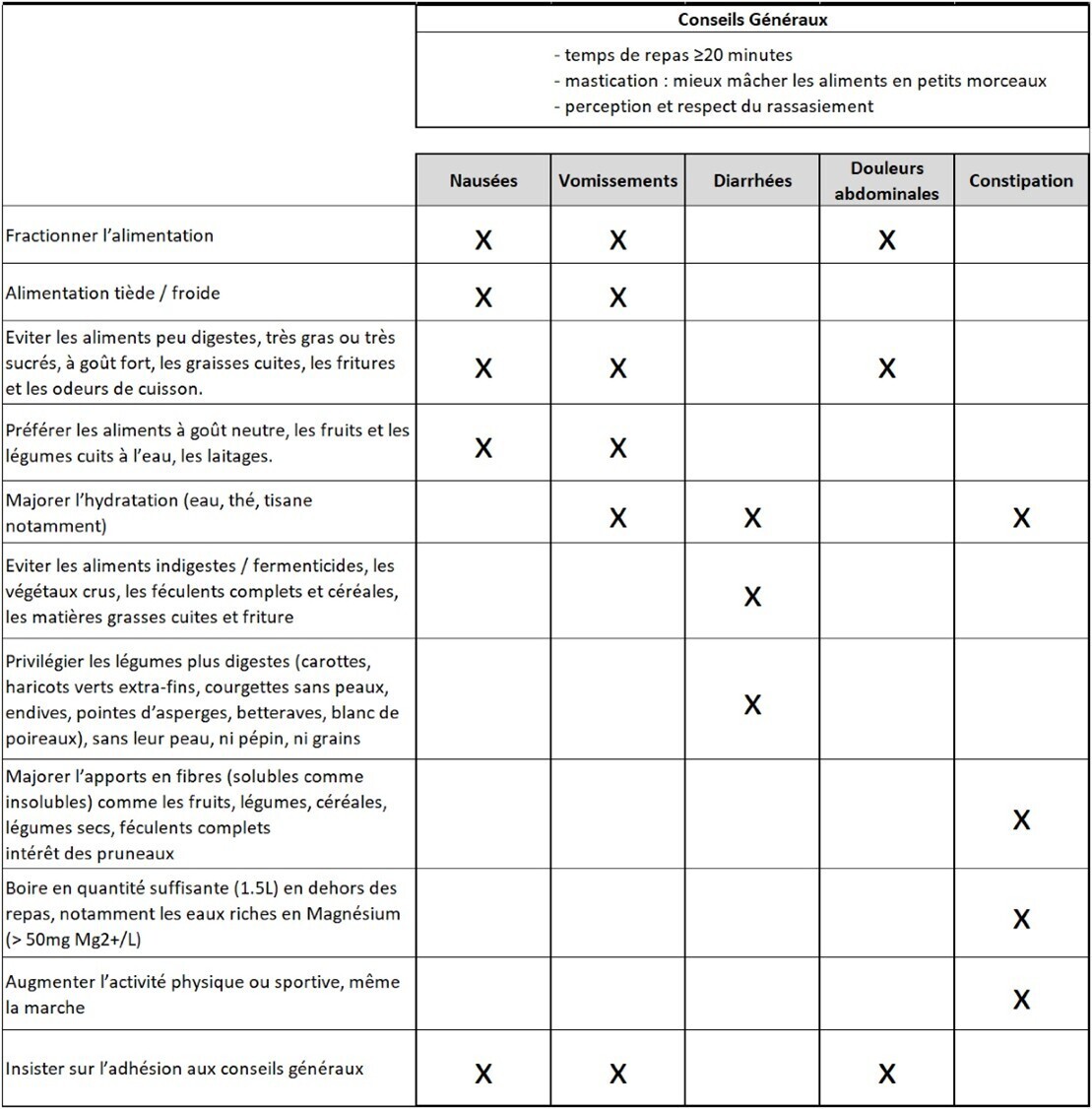
Gérer les EI digestifs
Le groupe de travail recommande d’informer le patient sur les éléments suivants :
- la survenue d’EI digestifs est fréquente sous TMO ;
- ils surviennent essentiellement pendant la phase d’escalade de dose ; ils sont habituellement temporaires et d’intensité légère à modérée. Ils n’entraînent que rarement l’arrêt du traitement (< 10 % dans les essais cliniques) ;
- les plus fréquents (dans les études) sont les nausées (25 à 44 %), les diarrhées (19 - 30 %), les vomissements (8 - 24 %) et la constipation (17 - 24 %). Les données en vie réelle et en pratique clinique montrent des fréquences plus élevées ;
- les EI digestifs semblent similaires entre liraglutide, sémaglutide et tirzépatide ;
- des EI digestifs sévères, invalidants ou persistants nécessitent l’avis du prescripteur.
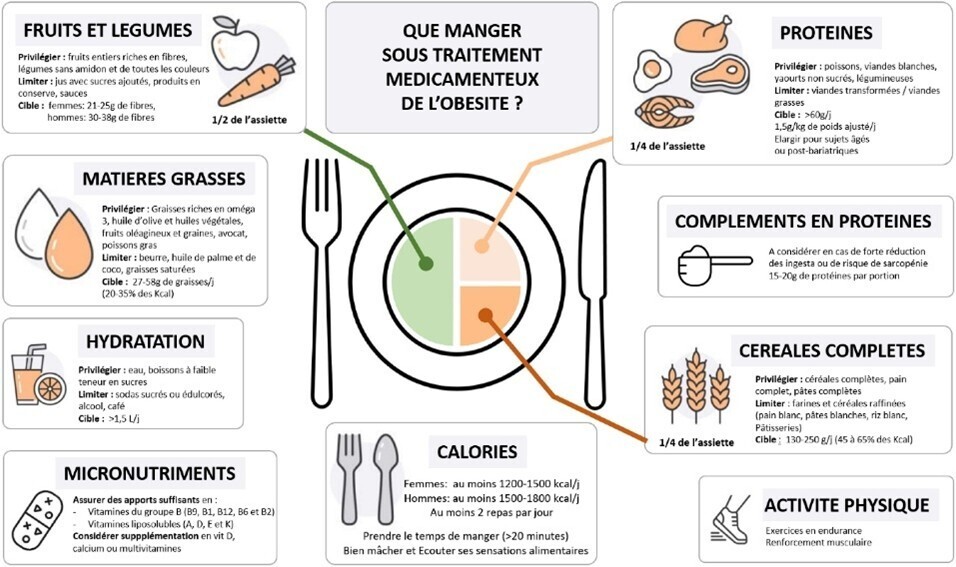
Pour permettre une bonne efficacité du TMO et une bonne tolérance digestive, il est important d’avoir travaillé en amont certains aspects du comportement alimentaire (détaillés en figure 5) : réduction du volume des repas, bonne mastication des aliments, écoute des sensations alimentaires, maintien d’une bonne hydratation et d’une alimentation variée.
Malgré ces mesures, si des EI digestifs surviennent, leur prise en charge repose en première intention sur des modifications diététiques, précisées dans la figure 6. L’utilisation temporaire de traitements symptomatiques est envisageable en 2e intention. Au besoin, une adaptation de la posologie du TMO, sa suspension ou son arrêt sont discutés.
Autres risques connus ou suspectés
Outre ces EI digestifs communs, il existe sous TMO un surrisque de :
- lithiase biliaire (discuter une prophylaxie de lithiase vésiculaire par acide ursodésoxycholique selon la situation) ;
- occlusion intestinale (rapporté dans une étude), appelant à une discussion spécifique chez les patients avec antécédent d’occlusion intestinale ;
- complications chez les patients atteints de rétinopathie diabétique et traités par sémaglutide. Le groupe de travail recommande donc de vérifier l’état rétinien en cas de DT2 avant d’initier un TMO, et de ne pas le débuter en cas de rétinopathie non stabilisée ;
- névrite optique antérieure ischémique non artéritique (NOIAN), effet secondaire très rare du sémaglutide. Si les patients présentent une perte ou une détérioration soudaine de la vision sous sémaglutide, le traitement doit être suspendu.
Dépister et prévenir les carences
Les signes d’alerte de risque carentiel ou de dénutrition sous TMO sont les suivants :
- réduction drastique des apports alimentaires, en particulier en protéines, ou aphagie ;
- perte de poids > 10 % à 3 mois, ou > 20 % à 6 mois ;
- atteinte d’un IMC < 18,5 ;
- diminution de la force musculaire ou apparition d’une obésité sarcopénique.
Une vigilance particulière s’impose chez les patients ayant des troubles digestifs majeurs (diarrhées, vomissements), un état inflammatoire aigu ou chronique. Ces situations doivent conduire à rechercher une cause sous-jacente à la dégradation de l’état nutritionnel (néoplasie, virage anorexique, conduites purgatives ou boulimie, etc.).
Il faut informer le patient que, dans les situations cliniques ci-dessus, il doit contacter le médecin prescripteur. Dans ces cas, les auteurs recommandent d’envisager une adaptation du traitement (désescalade de doses ou arrêt temporaire ou définitif) et de prendre avis auprès d’un professionnel compétent en nutrition.
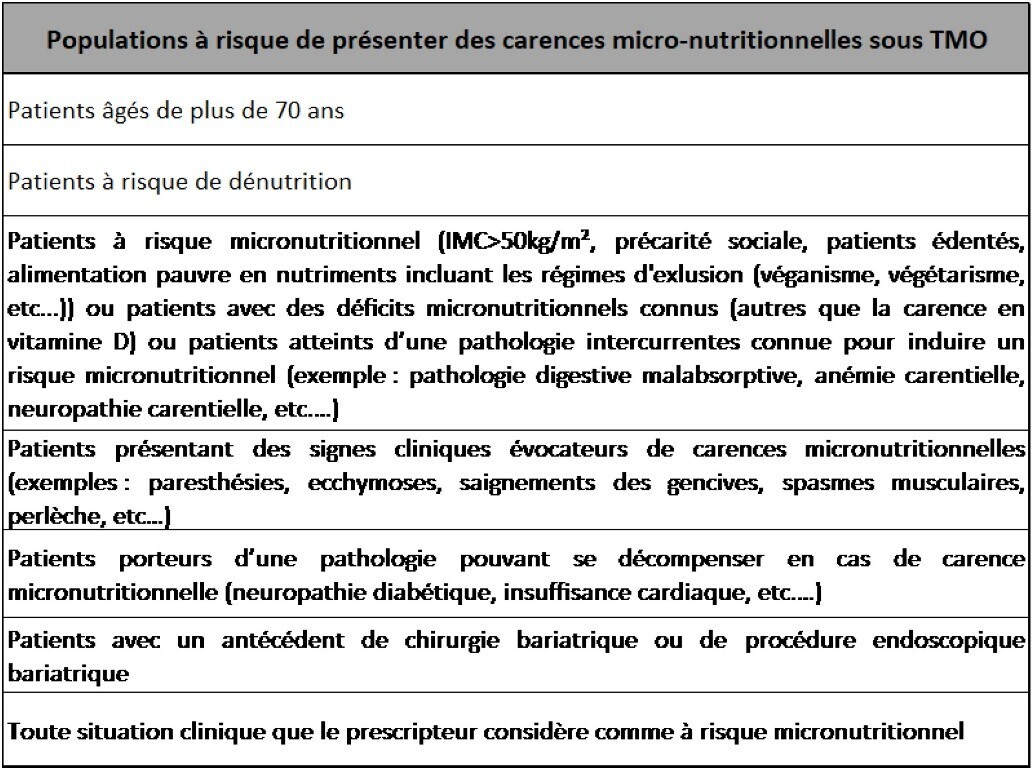
Par ailleurs, dès l’instauration du traitement, les spécialistes préconisent, dans les populations les plus à risque de carences micronutritionnelles (indiquées en figure 7) :
- un dépistage biologique des carences avant l’introduction du traitement et leurs corrections ;
- l’instauration d’emblée d’une supplémentation en vitamines et/ou en oligoéléments pour une durée d’au moins 6 mois ;
- une vigilance particulière en cas de perte de poids excessive et d’EI digestifs qui peuvent précipiter un état carentiel.
En l’absence de données dans la littérature, le groupe de travail propose au minimum le bilan sanguin initial suivant : NFS, plaquettes, ionogramme, coefficient de saturation, ferritine, créatinine, mesure de la clairance CKD-EPI, CRP, albumine, calcémie, vitamine B9 et B12.
Après l’introduction du TMO, certaines situations à risque justifient le dépistage d’une carence micronutritionnelle (en utilisant le bilan sanguin ci-dessus) :
- réduction drastique des apports alimentaires, en particulier en protéines, ou aphagie ;
- perte de poids > 10 % à 3 mois, ou > 20 % à 6 mois ;
- atteinte d’un IMC < 18,5 ;
- apparition de troubles digestifs d’intensité sévère (vigilance particulière en cas de vomissements), qui justifieront d’une supplémentation parentérale en vitamine B1 ;
- décompensation d’une pathologie qui peut être associée à une carence en micronutriments (neuropathie périphérique, insuffisance cardiaque, etc.) ;
- apparition de signes cliniques évocateurs d’une carence.
Martin Agudelo L. Prescription des aGLP-1 dans l’obésité en MG : comment faire, en pratique ? Rev Prat (en ligne) 30 juin 2025.
Pour en savoir plus :
Mallordy F. Obésité : les aGLP-1 en 1re ligne contre les complications. Rev Prat (en ligne) 3 novembre 2025.
Nobile C. Surpoids/obésité : nouvelles recos de la HAS pour le médecin traitant. Rev Prat (en ligne) 29 février 2024.
Martin Agudelo L. Surpoids et obésité chez la femme : nouvelles recos HAS. Rev Prat (en ligne) 6 mars 2025.
Mallordy F. Effet yoyo après l’arrêt des aGLP-1 ? Rev Prat (en ligne) 28 août 2025.