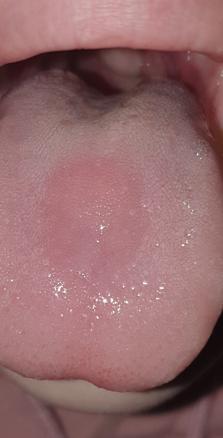
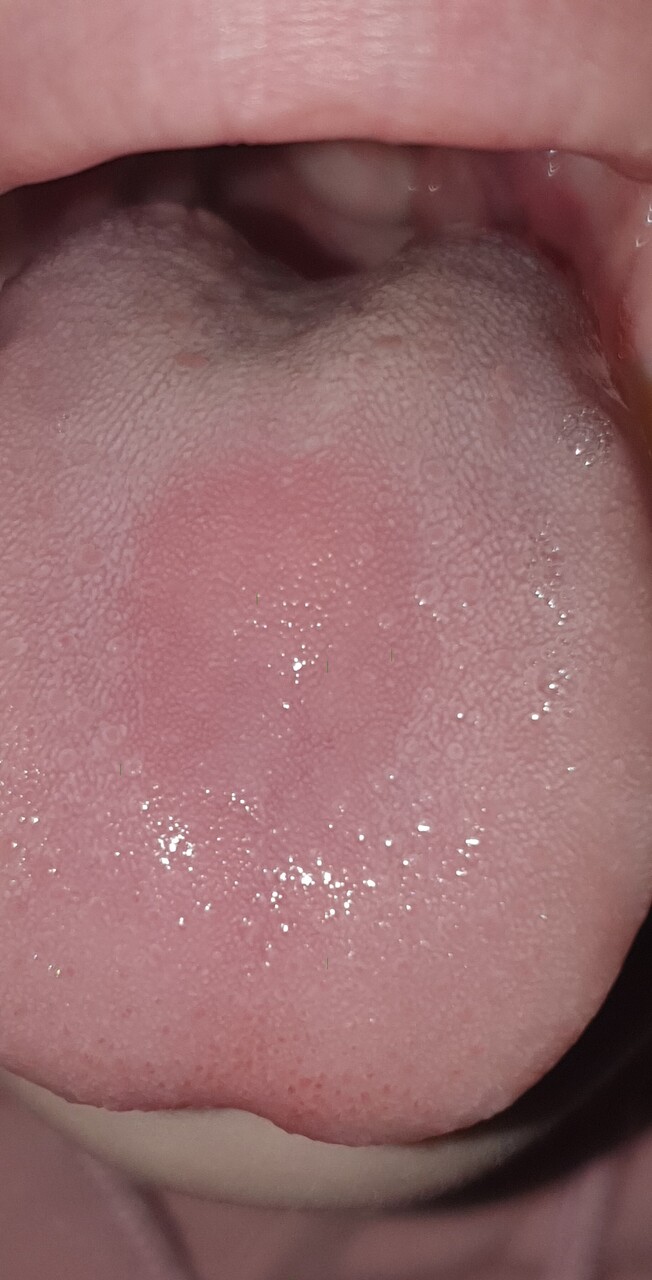
Magalie, 22 ans, consulte pour une lésion érythémateuse apparue il y a quelques mois sur la partie centrale de sa langue (figure).
Pour en savoir plus
Benslama L. Les pathologies de la muqueuse buccale. Éd. CdP 2024.
0
Alopécie secondaire a un zona
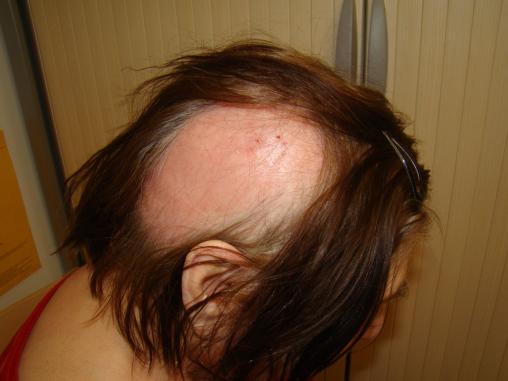
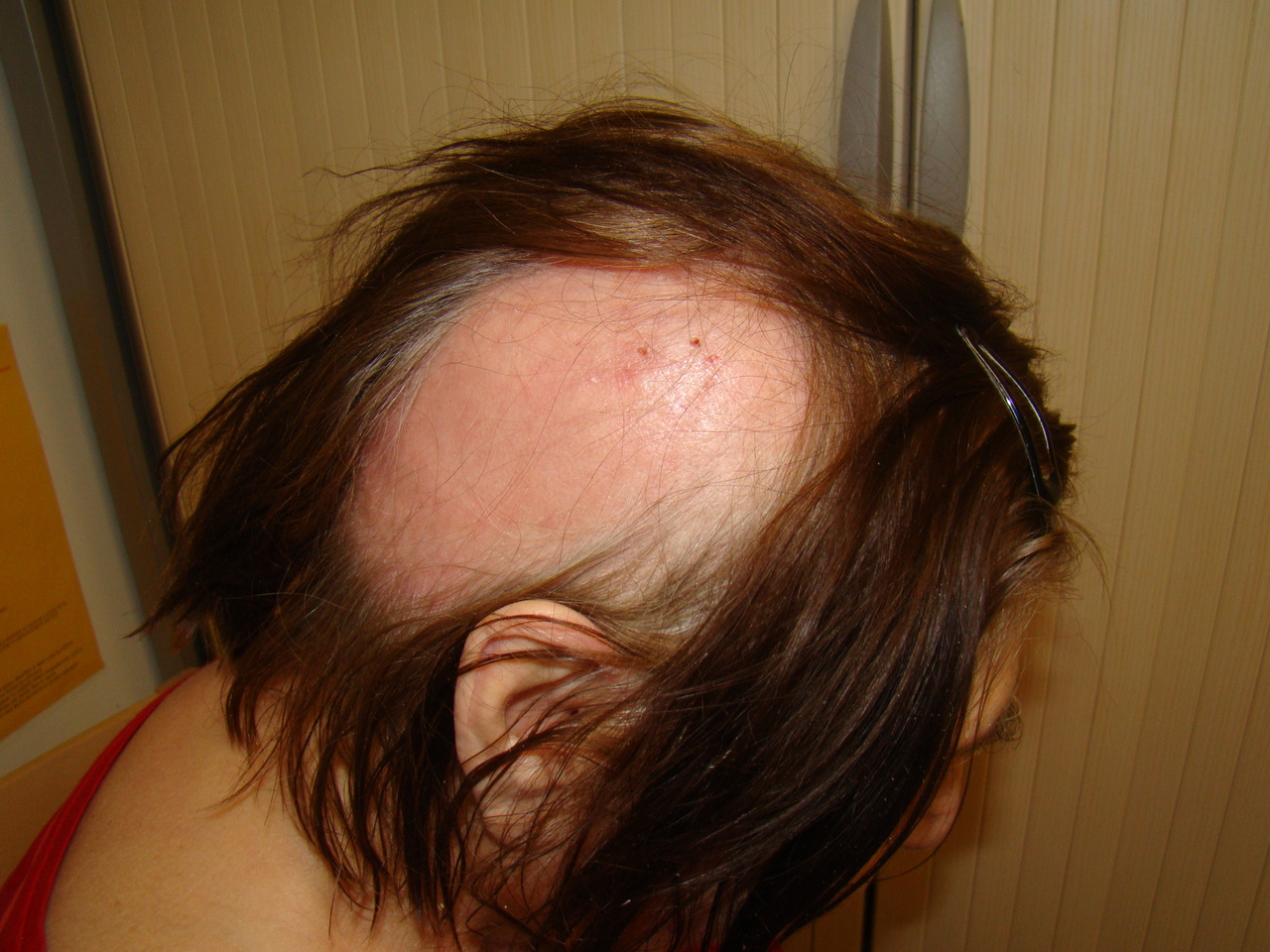
Une infirmière d’Ehpad demande une consultation médicale pour une résidente de 60 ans, oligophrène, qui se plaint de douleurs hémicrâniennes du côté droit, intenses, depuis plus de sept jours. L’examen clinique montre la présence d’un placard alopéciant au niveau de la zone douloureuse, avec quelques croûtes en son centre (figure). La patiente avait eu une éruption érythémato-vésiculeuse dix jours auparavant, s’étendant depuis la base du rachis cervical et se développant en bande au niveau du cuir chevelu.
Pour en savoir plus
Bouhanna P, Reygagne P. Pathologie du cheveu et du cuir chevelu. Paris: Masson, 1999.
0
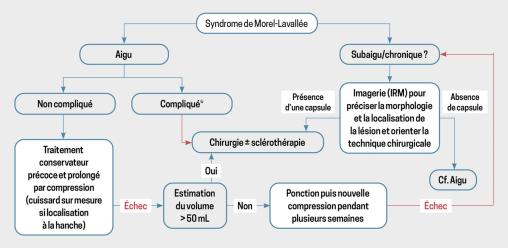
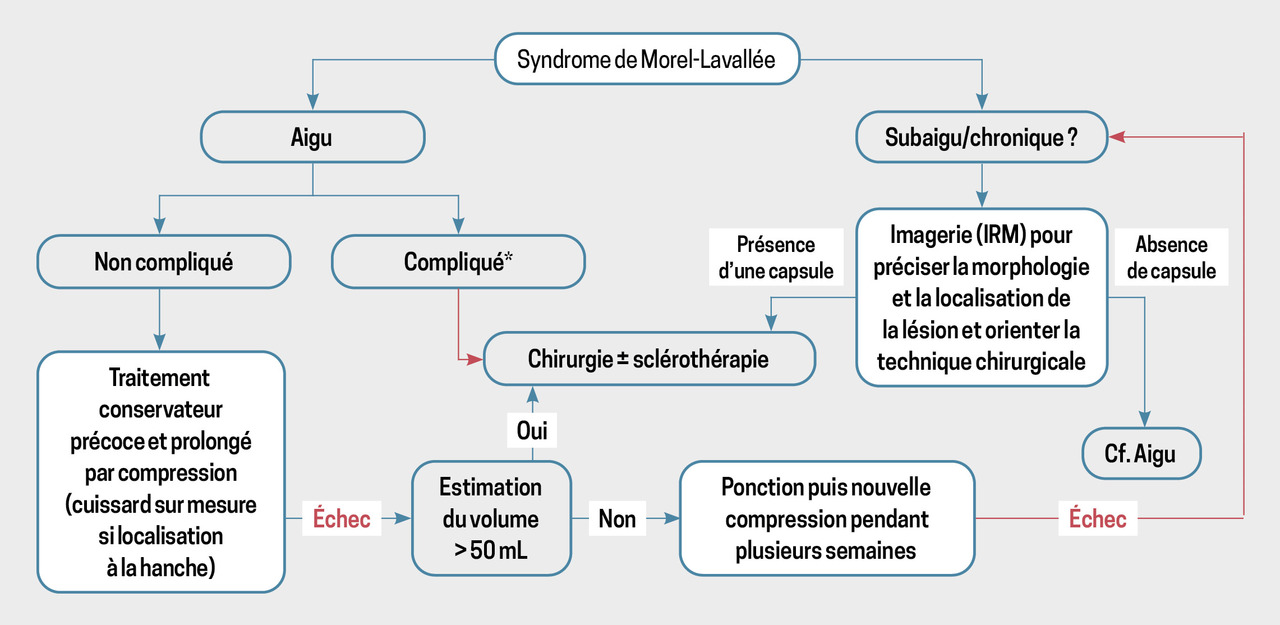
Syndrome de Morel-Lavallée
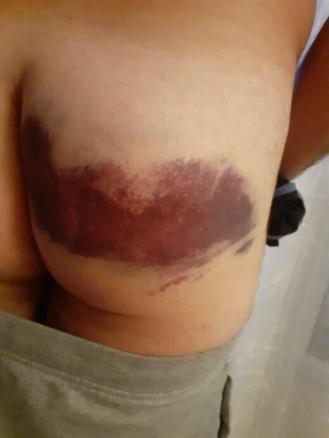
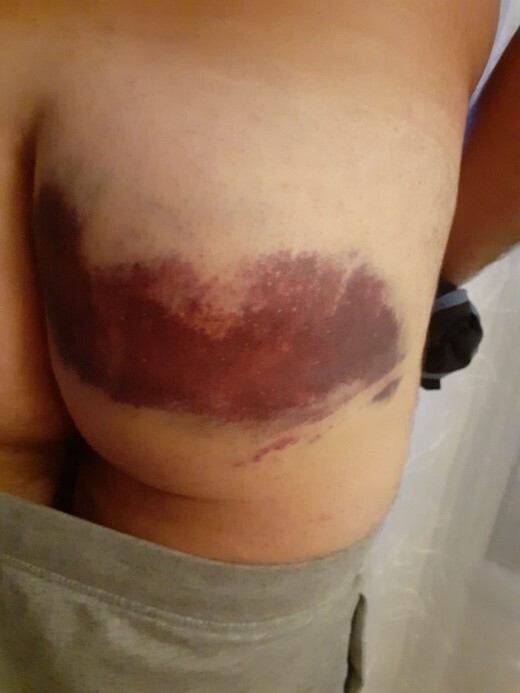
Un militaire de 48 ans consulte pour une tuméfaction importante située au niveau de sa fesse droite. Il évoque une chute dans les escaliers ayant eu lieu un mois auparavant avec apparition d’un hématome d’environ 30 cm de diamètre, couvrant une large partie du grand fessier droit. Des photos ont été prises le lendemain de la chute (fig. 1). L’hématome a disparu complètement en deux semaines.
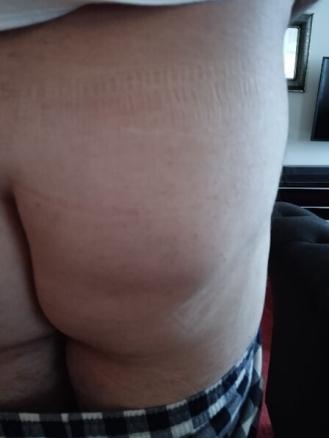
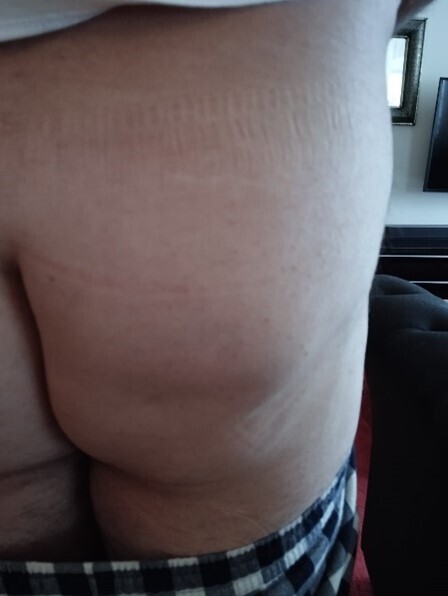
Un mois après le traumatisme, il constate l’apparition d’une tuméfaction collectée d’une quinzaine de centimètres sur le quadrant inférieur de la fesse.
Une échographie est réalisée, mettant en évidence une collection liquidienne hypodermique partiellement cloisonnée, non inflammatoire en doppler énergie, au contenu finement échogène. La tuméfaction, compressible sous la sonde, mesure 15 cm de diamètre et 1,5 cm d’épaisseur. Une ponction est préconisée, permettant d’évacuer 120 mL de liquide sérosanglant, avec affaissement quasi complet de la collection. Un bandage compressif est mis en place, mais la collection récidive quelques semaines plus tard (fig. 2).
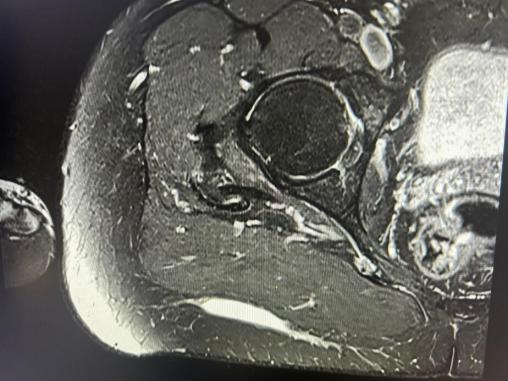
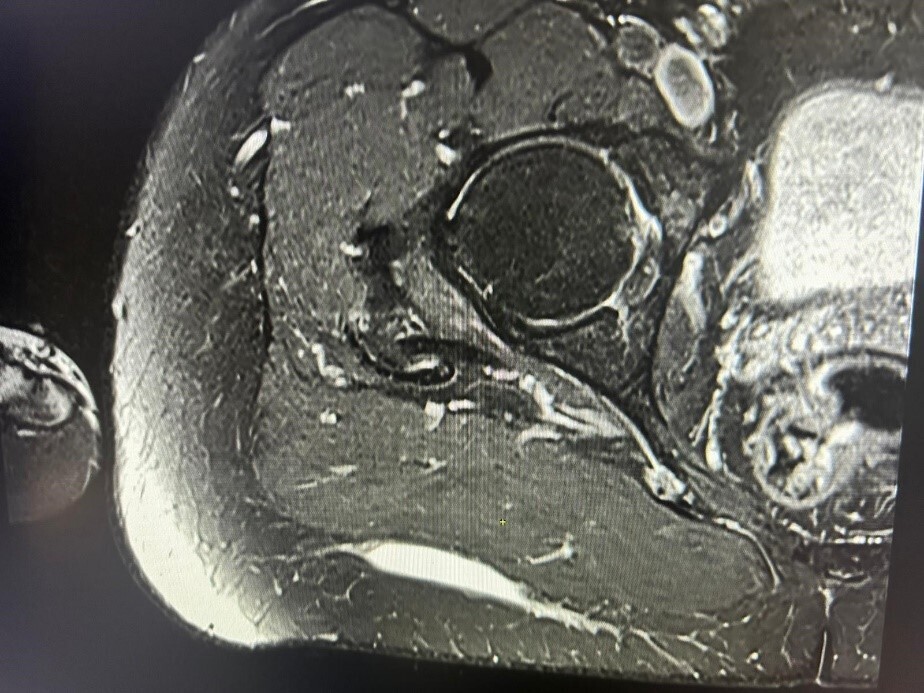
Une IRM est alors effectuée, concluant à une collection liquidienne évocatrice de saignement, sans capsule visualisée. Elle mesure 8,5 cm de grand axe et 0,6 cm de petit axe et est localisée en arrière du fascia musculaire superficiel du grand glutéal (fig. 3).
Devant l’aspect clinique de collection récidivante séro-hématique post-traumatique et l’aspect compatible en IRM, le diagnostic de syndrome de Morel-Lavallée est évoqué.
Un avis chirurgical orthopédique est demandé afin de discuter l’indication d’un débridement. Cette option n’est finalement pas retenue en raison du risque infectieux et d’un bénéfice discutable.
Un repos sportif de vingt-quatre mois avec un caleçon compressif est préconisé.
Quelques mois plus tard, la collection est toujours présente, mais dans un moindre volume. Une surveillance de l’évolution (recherche d’un encapsulement) par imagerie est proposée.
Un mois après le traumatisme, il constate l’apparition d’une tuméfaction collectée d’une quinzaine de centimètres sur le quadrant inférieur de la fesse.
Une échographie est réalisée, mettant en évidence une collection liquidienne hypodermique partiellement cloisonnée, non inflammatoire en doppler énergie, au contenu finement échogène. La tuméfaction, compressible sous la sonde, mesure 15 cm de diamètre et 1,5 cm d’épaisseur. Une ponction est préconisée, permettant d’évacuer 120 mL de liquide sérosanglant, avec affaissement quasi complet de la collection. Un bandage compressif est mis en place, mais la collection récidive quelques semaines plus tard (fig. 2).
Une IRM est alors effectuée, concluant à une collection liquidienne évocatrice de saignement, sans capsule visualisée. Elle mesure 8,5 cm de grand axe et 0,6 cm de petit axe et est localisée en arrière du fascia musculaire superficiel du grand glutéal (fig. 3).
Devant l’aspect clinique de collection récidivante séro-hématique post-traumatique et l’aspect compatible en IRM, le diagnostic de syndrome de Morel-Lavallée est évoqué.
Un avis chirurgical orthopédique est demandé afin de discuter l’indication d’un débridement. Cette option n’est finalement pas retenue en raison du risque infectieux et d’un bénéfice discutable.
Un repos sportif de vingt-quatre mois avec un caleçon compressif est préconisé.
Quelques mois plus tard, la collection est toujours présente, mais dans un moindre volume. Une surveillance de l’évolution (recherche d’un encapsulement) par imagerie est proposée.
Références
1. Delannoy G, Peyrottes A. Le syndrome de Morel-Lavallée : physiopathologie, présentation clinique et prise en charge. Journal de traumatologie du sport 2021;38(3):168‑72.
2. Pothiawala S, Miranda R, Civil I. Not all post-traumatic swellings are haematomas: Be alert to a Morel-Lavallee lesion. Lancet 2022;400(10345):e1.
3. Amaravathi U, Singh S, Reddy AA, et al. The Morel-Lavallee lesion. J Emerg Med 2023;64(1):67‑9.
4. Wahhab J, Zwijack A. Beware the ides of Morel-Lavallee: A lesion to consider when diagnosing trauma patients. Trauma Case Rep 2023;47:100917.
5. Meriglier E, Chretien A, Bencheikh S, et al. Effet de la sclérothérapie par doxycycline dans le syndrome de Morel- Lavallée. Rev Med Interne 2022;43(2):132‑3.
2. Pothiawala S, Miranda R, Civil I. Not all post-traumatic swellings are haematomas: Be alert to a Morel-Lavallee lesion. Lancet 2022;400(10345):e1.
3. Amaravathi U, Singh S, Reddy AA, et al. The Morel-Lavallee lesion. J Emerg Med 2023;64(1):67‑9.
4. Wahhab J, Zwijack A. Beware the ides of Morel-Lavallee: A lesion to consider when diagnosing trauma patients. Trauma Case Rep 2023;47:100917.
5. Meriglier E, Chretien A, Bencheikh S, et al. Effet de la sclérothérapie par doxycycline dans le syndrome de Morel- Lavallée. Rev Med Interne 2022;43(2):132‑3.
0
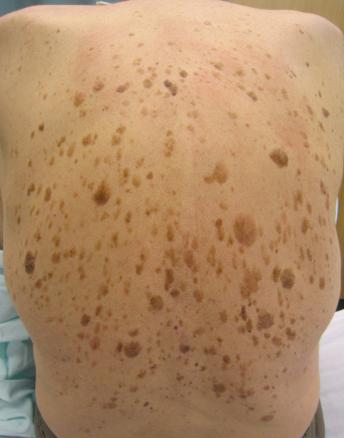
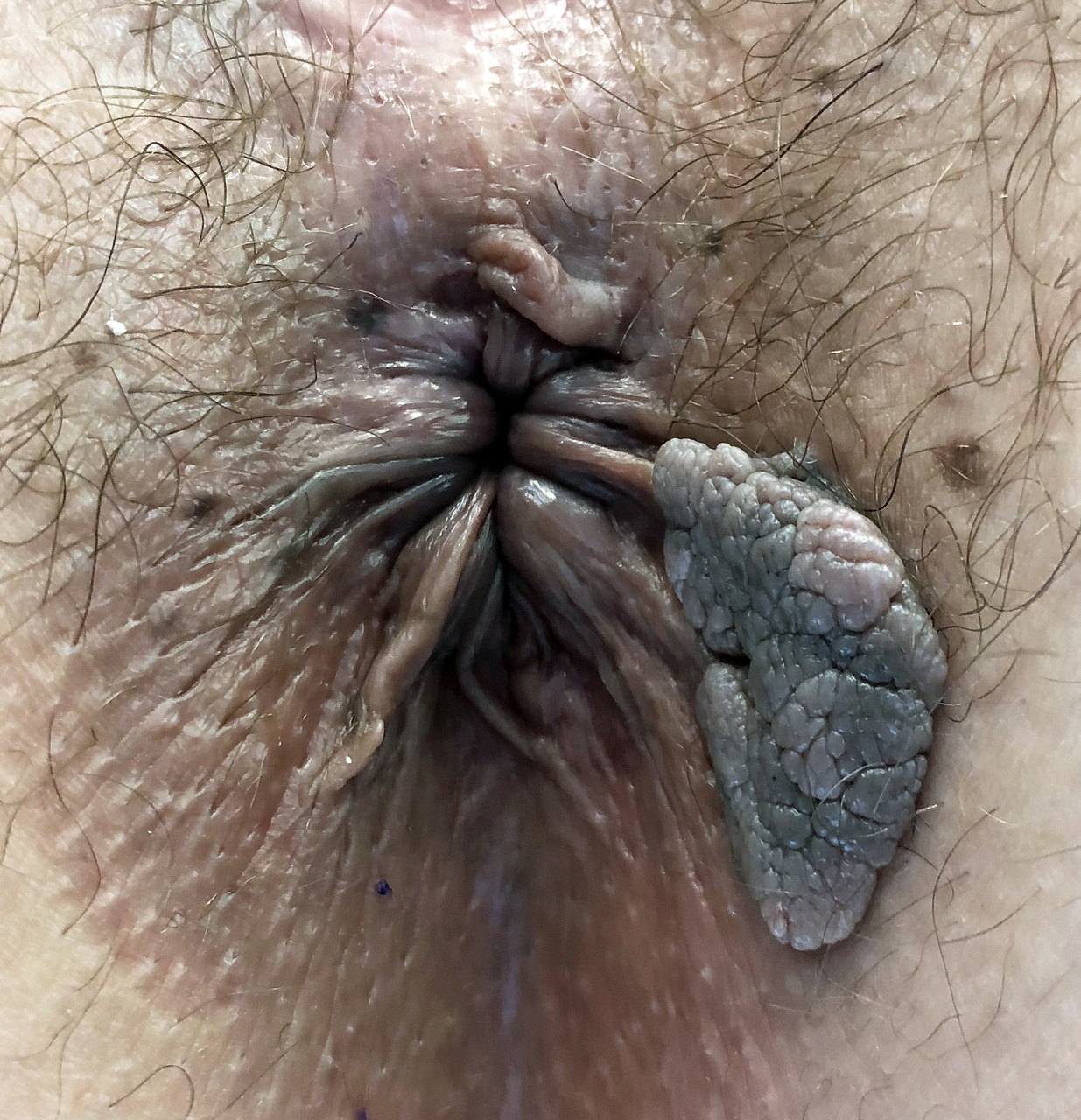
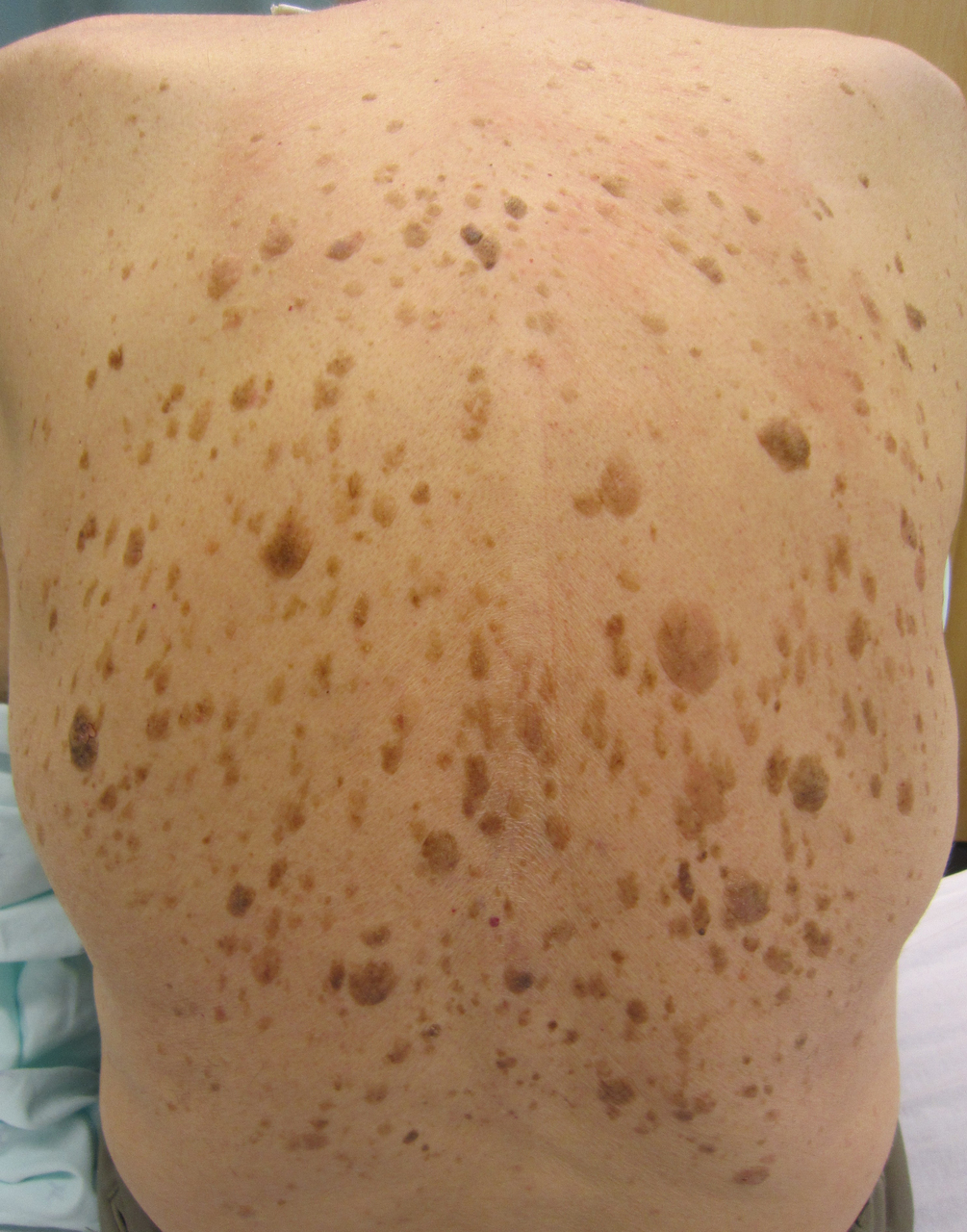
Kératose séborrhéique
Une femme de 55 ans consulte pour un « relief » périanal indolore, mais qui l’inquiète. L’examen clinique montre une tuméfaction proche de la marge anale (fig. 1).
Pour en savoir plus
Wollina U, Chokoeva A, Tchernev G, Heinig B, Schönlebe J. Anogenital giant seborrheic keratosis. G Ital Dermatol Venereol 2017;152:383-6.
Gorai S, Ahmad S, Raza SSM, et al. Update of pathophysiology and treatment options of seborrheic keratosis. Dermatol Ther 2022;35:e15934.
Gorai S, Ahmad S, Raza SSM, et al. Update of pathophysiology and treatment options of seborrheic keratosis. Dermatol Ther 2022;35:e15934.
0
Échographie clinique ciblée
- En savoir plus sur Échographie clinique ciblée
- Se connecter ou s'inscrire pour poster un commentaire
Dépistage organisé du cancer pulmonaire
- En savoir plus sur Dépistage organisé du cancer pulmonaire
- Se connecter ou s'inscrire pour poster un commentaire
Faut-il opérer tous les polypes colorectaux ?
- En savoir plus sur Faut-il opérer tous les polypes colorectaux ?
- Se connecter ou s'inscrire pour poster un commentaire
Pertes de grossesse à répétition
- En savoir plus sur Pertes de grossesse à répétition
- Se connecter ou s'inscrire pour poster un commentaire
Le médecin généraliste face au patient avec déficience intellectuelle
- En savoir plus sur Le médecin généraliste face au patient avec déficience intellectuelle
- Se connecter ou s'inscrire pour poster un commentaire
Fièvre prolongée inexpliquée de l’adulte
- En savoir plus sur Fièvre prolongée inexpliquée de l’adulte
- Se connecter ou s'inscrire pour poster un commentaire