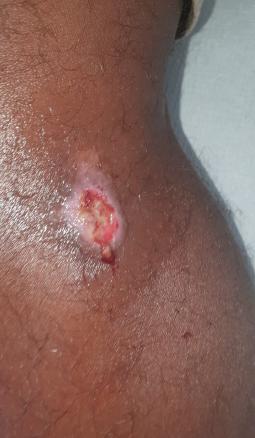
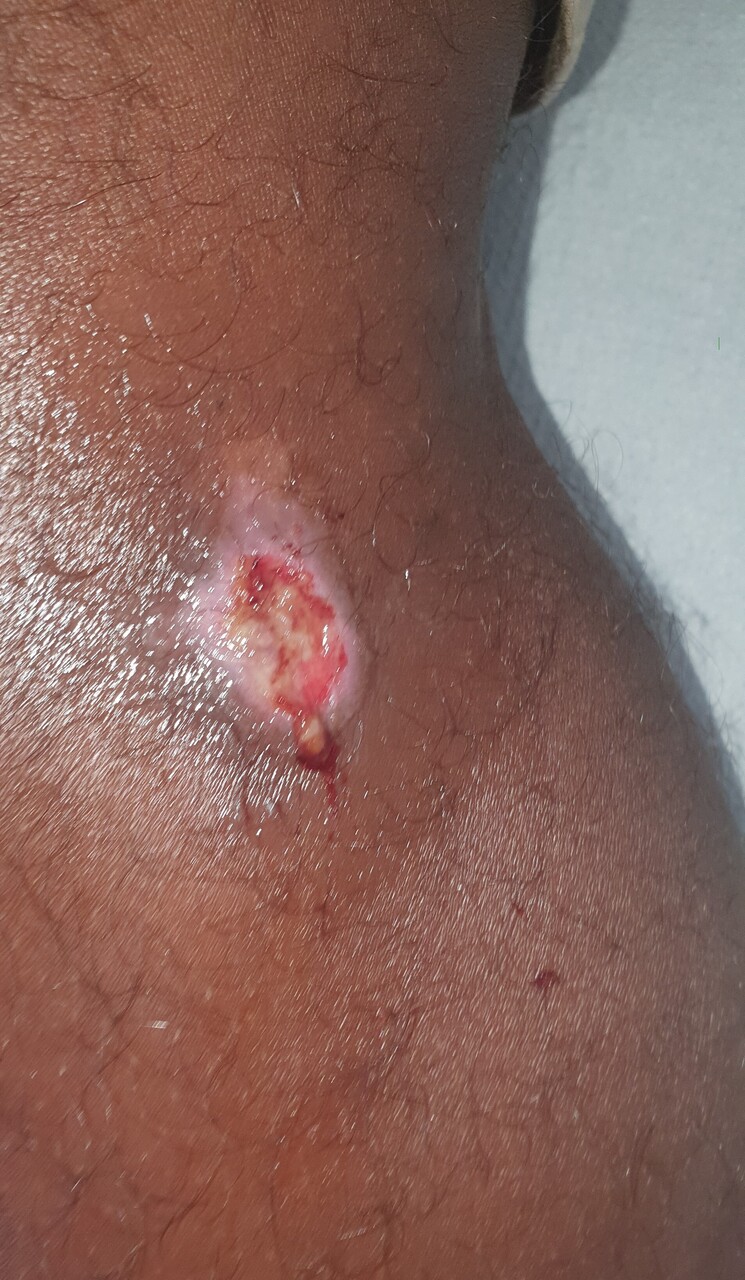
Ashraf, 15 ans, en provenance de Mayotte, consulte pour de multiples ulcérations au niveau des jambes (figure). Apparues il y a plus de quinze jours, ces lésions persistent en dépit de soins locaux. Un prélèvement est effectué.
Pour en savoir plus
Marsollier L, Aubry A, Carbonnelle E, et al. Mycobactéries cutanées dues à Mycobacterium ulcerans, Mycobacterium marinum, Mycobacterium abscessus, Mycobacterium chelonae et autres mycobactéries non tuberculeuses. EMC Maladies infectieuses 2020;37(3):1-14.
0
Psoriasis flexural
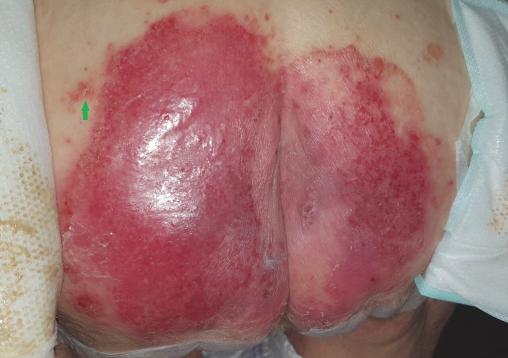
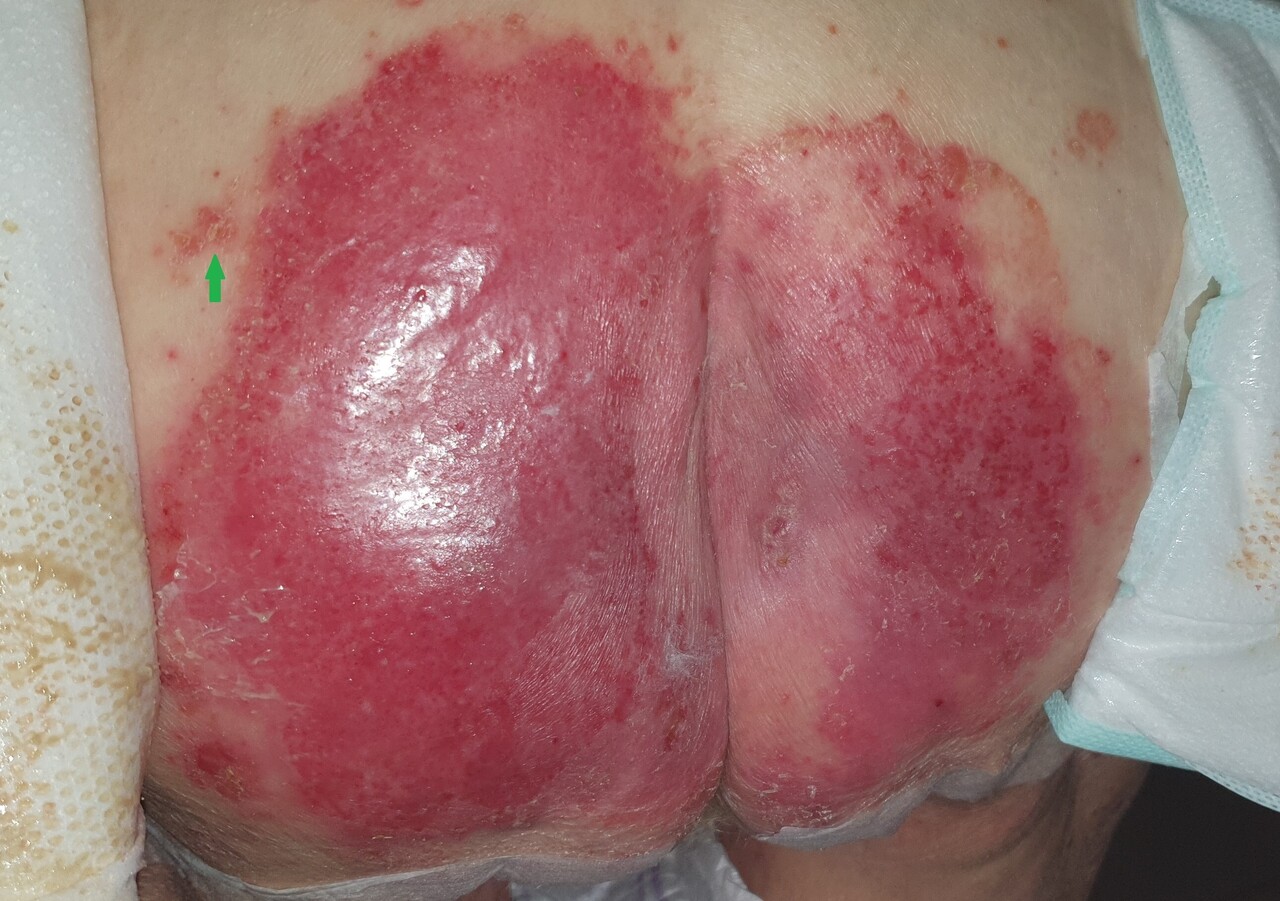
À la demande des infirmières, Monique, 75 ans, consulte pour des lésions au niveau du siège (figure). Malgré l’application consciencieuse d’émollients et d’antifongiques locaux, un imposant placard s’est développé et persiste. Outre la présence d’une zone érythémateuse très étendue mais bien limitée, l’examen clinique objective des placards érythémato-squameux en périphérie (figure, flèche verte) et des lésions similaires au niveau des coudes.
Pour en savoir plus
Micali G, Verzi AE, Giuffrida G, et al. Inverse psoriasis : From diagnosis to current treatment options. Clin Cosmet Investig Dermatol 2019;12:953-9.
0
Syndrome de Leser-Trélat
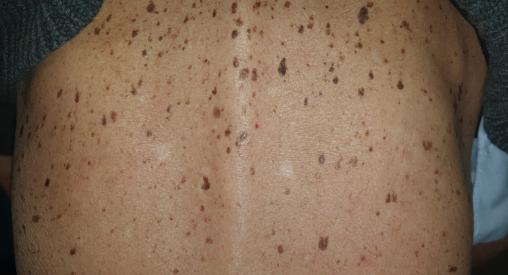
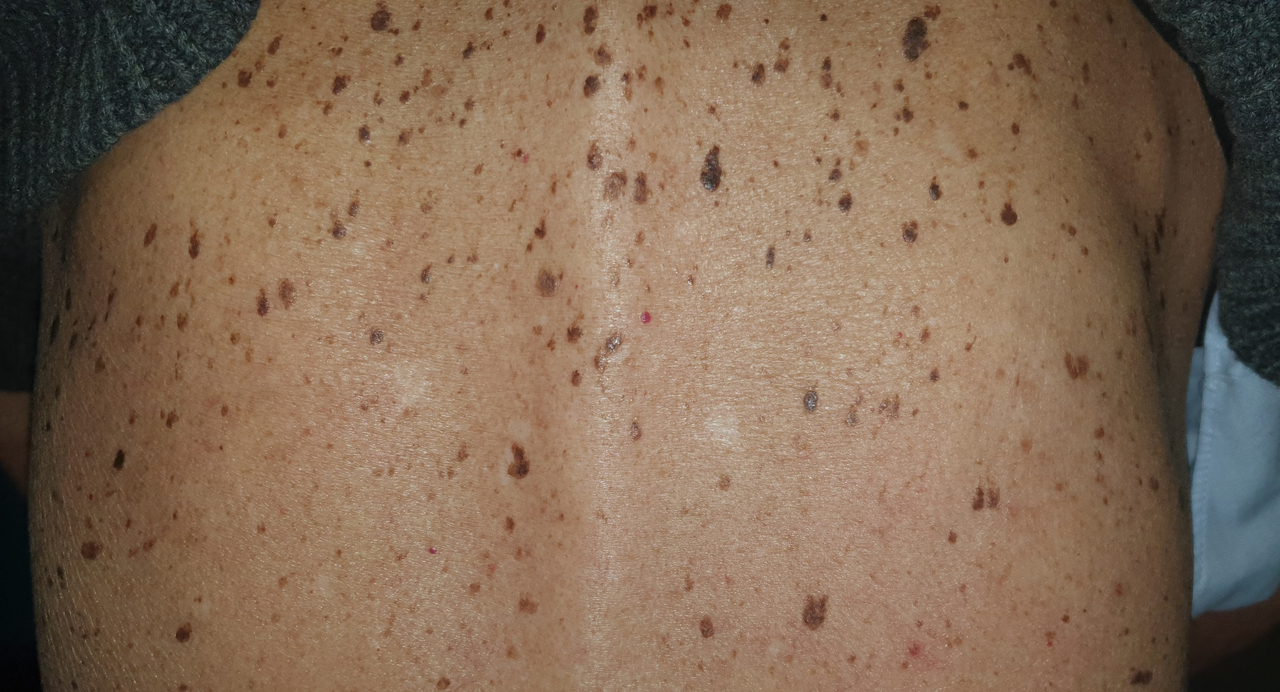
Jules, 68 ans, consulte pour une efflorescence rapide de lésions pigmentées au niveau du dos et du thorax, dont certaines lésions se détachent (figure). Il explique ne plus avoir d’appétit depuis trois mois, décrit des douleurs épigastriques parfois intenses et a constaté une perte de poids de 5 kg. Des explorations sont réalisées, permettant de poser le diagnostic d’adénocarcinome gastrique.
Pour en savoir plus
Husain Z, Ho JK, Hantash BM. Sign and pseudo-sign of Leser-Trelat: case report and a review of the literature. Journal of Drugs Dermatol 2013;12(5):e79-e87.
0
Molluscum pendulum
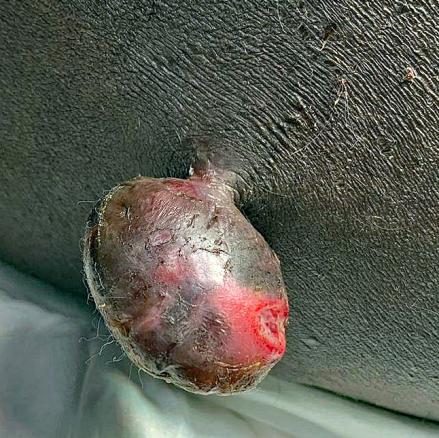
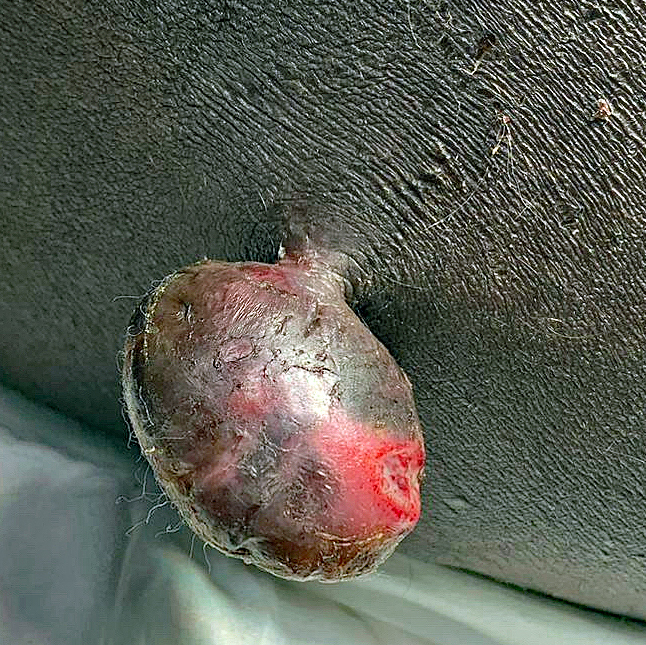
Un homme de 68 ans consulte pour une « boule » gênante depuis quelques semaines. L’examen clinique révèle une masse pédiculée de la fesse (fig. 1).
Pour en savoir plus
Curtis JR, Hurst E, Lee M, et al. A true molluscum pendulum. Int J Dermatol 2007;46:853-4.
Gaurav V, Grover C. “Molluscum” Conditions in Dermatology. Indian Dermatol Online J 2021;12:962-5.
Gaurav V, Grover C. “Molluscum” Conditions in Dermatology. Indian Dermatol Online J 2021;12:962-5.
0
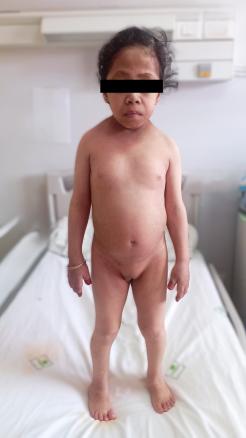
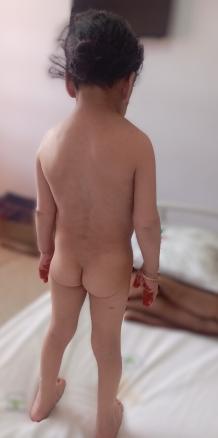
Syndrome de Turner
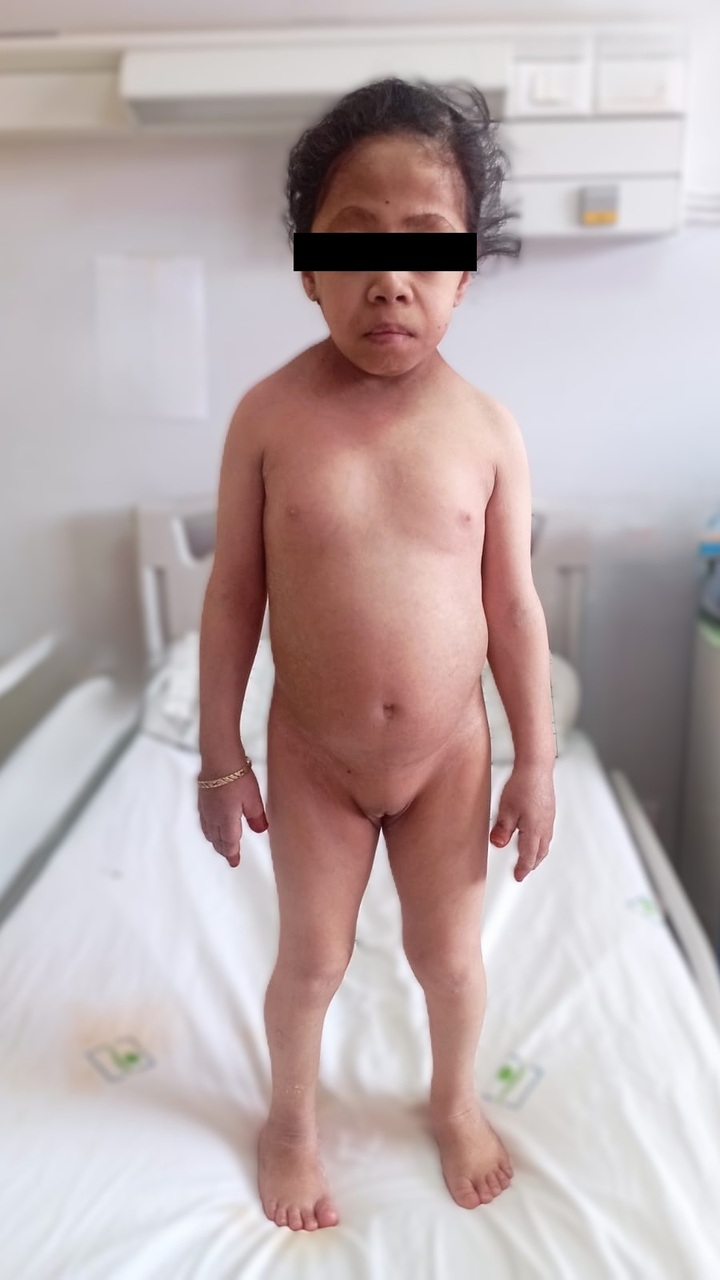
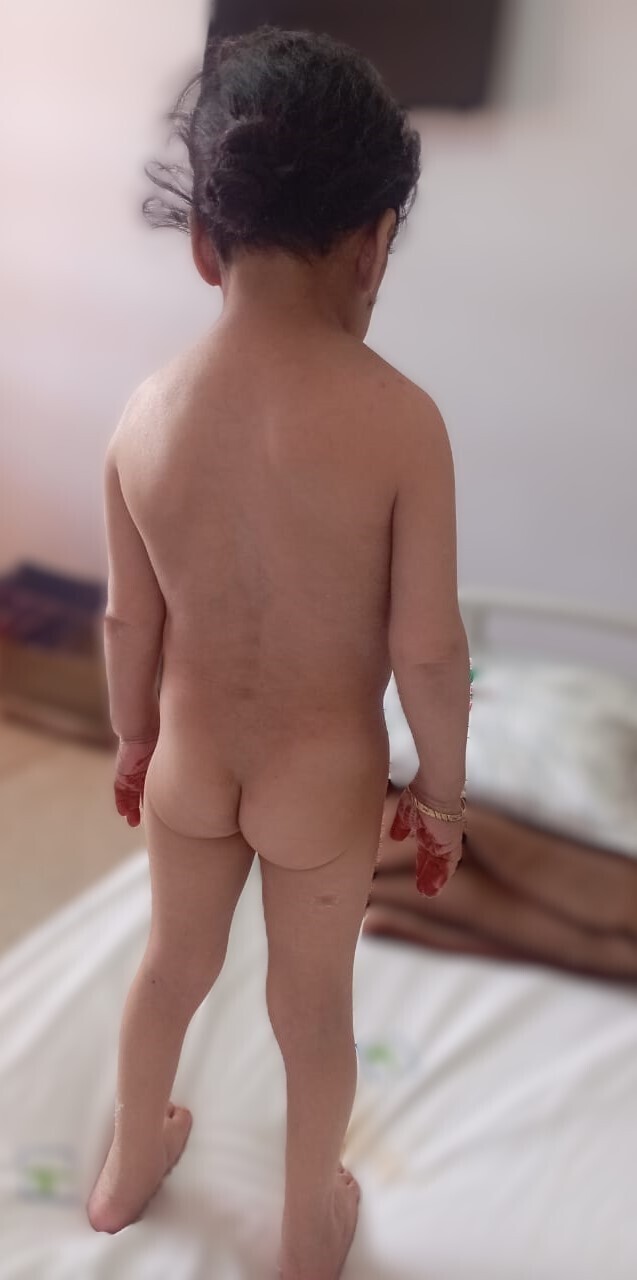
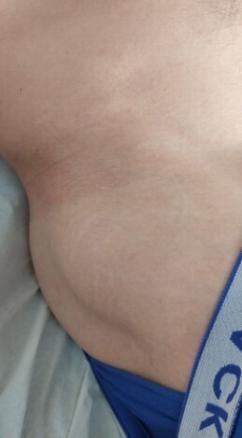
Une patiente âgée de 30 ans est vue en consultation pour une hypothyroïdie profonde, avec un taux de thyréostimuline ultrasensible (TSHus) supérieur à 500 mUI/L. L’examen clinique objective une taille à 98 cm, un poids à 16 kg, un retard pubertaire au stade S1 P1 selon la classification de Tanner et un syndrome dysmorphique, avec un front bombé, une implantation basse des cheveux, un hypertélorisme, un cou palmé court et un écartement mamelonnaire (fig. 1 et 2). L’examen clinique met également en évidence une vulve infantile avec des lésions achromiques au niveau des grandes lèvres, faisant évoquer un vitiligo (fig. 3).
Les explorations paracliniques révèlent un profil hormonal en faveur d’un hypogonadisme hypergonadotrope et un âge osseux de 4 ans et demi. L’étude génétique confirme le diagnostic de syndrome de Turner à l’état homogène (dysgénésie ovarienne avec phénotype féminin et caryotype 45X0).
Un traitement hormonal substitutif thyroïdien et par hormone de croissance est débuté.
Les explorations paracliniques révèlent un profil hormonal en faveur d’un hypogonadisme hypergonadotrope et un âge osseux de 4 ans et demi. L’étude génétique confirme le diagnostic de syndrome de Turner à l’état homogène (dysgénésie ovarienne avec phénotype féminin et caryotype 45X0).
Un traitement hormonal substitutif thyroïdien et par hormone de croissance est débuté.
Références
1. Gravholt Ch, Viuff MH, Brun S et al. Turner syndrome: Mechanisms and management. Nat Rev Endocrinol 2019;15(10):601-14.
2. De Sanctis V, Khater D. Autoimmune diseases in Turner syndrome: An overview Acta Biomed 2019;90(3):341-4.
2. De Sanctis V, Khater D. Autoimmune diseases in Turner syndrome: An overview Acta Biomed 2019;90(3):341-4.
0
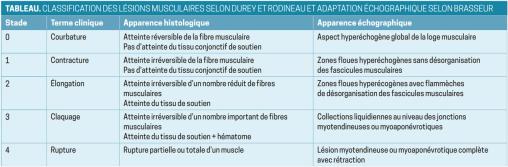
Traumatisme musculaire
Un patient de 34 ans, militaire, sans antécédent notable, consulte pour une gêne au niveau de la cuisse droite évoluant depuis trois semaines, apparue à la suite d’un traumatisme du membre inférieur droit lors d’une partie de bubble foot. Allongé au sol, il aurait cherché à récupérer la balle dans un mouvement d’hyperextension de la cuisse.
Dans les suites immédiates, il a ressenti de fortes douleurs d’horaire mécanique limitant les activités sportives et de la vie quotidienne. Ces douleurs se sont progressivement amendées sans prise en charge particulière. Il consulte du fait d’une gêne persistante.
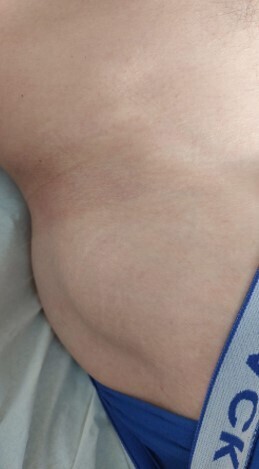
À l’examen clinique, le patient n’a pas de limitation d’amplitude articulaire ni de douleur à la mobilisation active ou passive du membre inférieur droit ; les réflexes ostéotendineux sont conservés dans leur ensemble. Cependant, en décubitus dorsal, une voussure en regard de la face supéro-latérale de la cuisse droite est retrouvée sans hématome en périphérie ni douleur à la palpation (fig. 1).
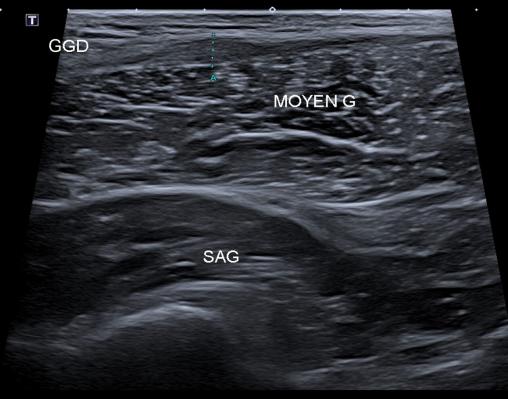
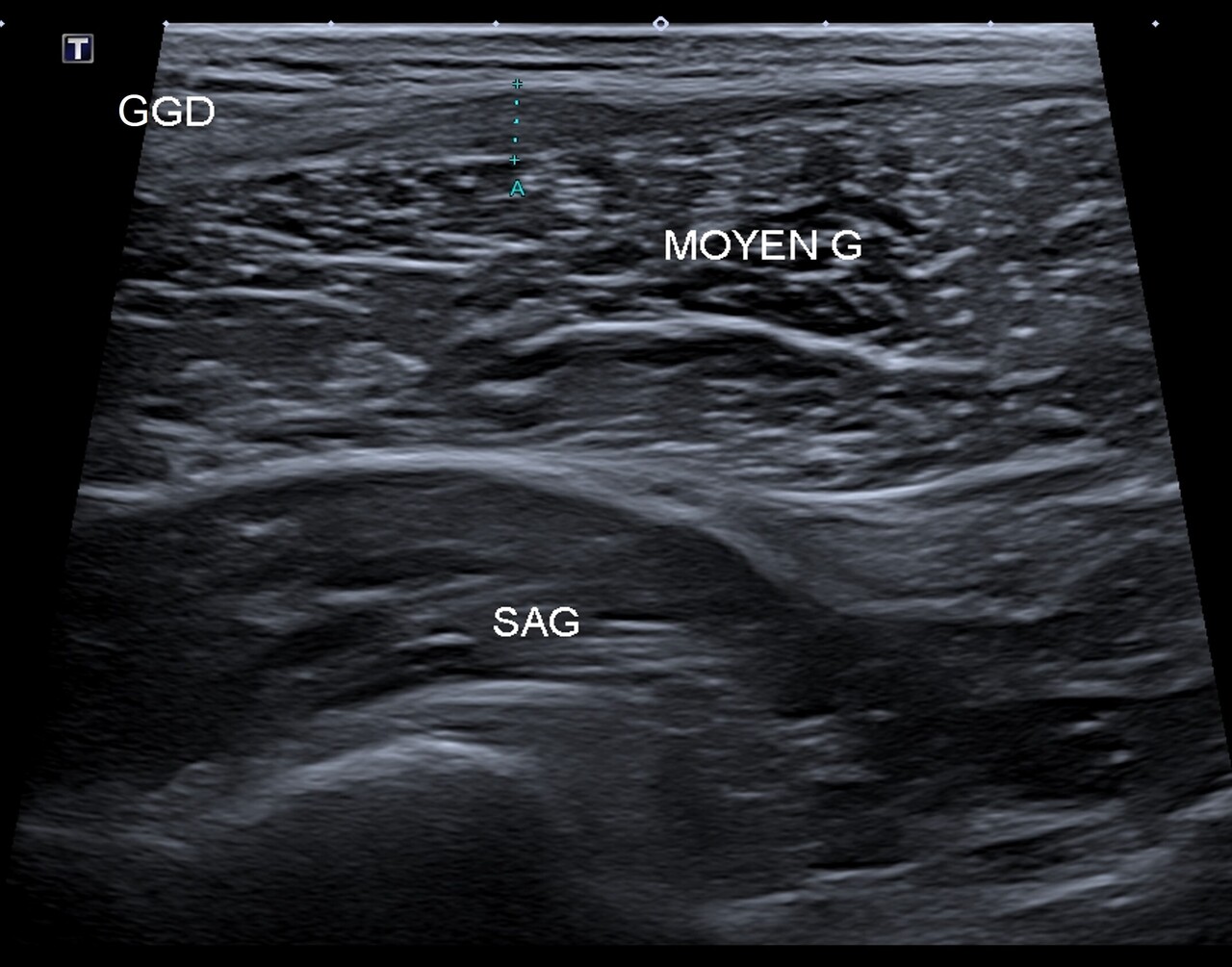
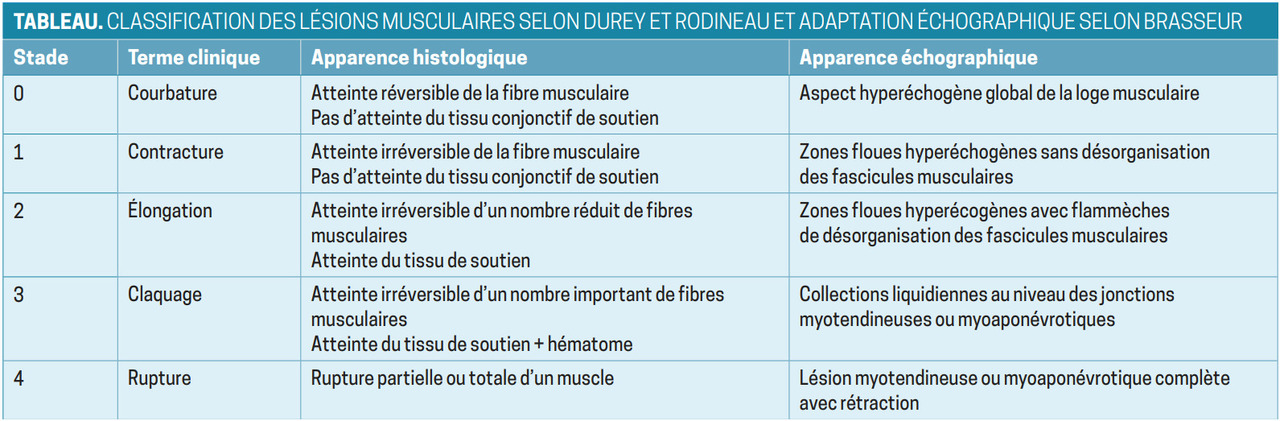
Une échographie musculaire est prescrite, avec consigne d’arrêter toute pratique sportive. L’examen met en évidence une lésion conjonctive intrinsèque de l’aponévrose du muscle grand glutéal classée stade 2 (fig. 2).
La prise en charge consiste, devant le délai, en un traitement fonctionnel avec consigne de repos sportif court avant reprise progressive de l’activité physique médiée par un kinésithérapeute.
Dans les suites immédiates, il a ressenti de fortes douleurs d’horaire mécanique limitant les activités sportives et de la vie quotidienne. Ces douleurs se sont progressivement amendées sans prise en charge particulière. Il consulte du fait d’une gêne persistante.
À l’examen clinique, le patient n’a pas de limitation d’amplitude articulaire ni de douleur à la mobilisation active ou passive du membre inférieur droit ; les réflexes ostéotendineux sont conservés dans leur ensemble. Cependant, en décubitus dorsal, une voussure en regard de la face supéro-latérale de la cuisse droite est retrouvée sans hématome en périphérie ni douleur à la palpation (fig. 1).
Une échographie musculaire est prescrite, avec consigne d’arrêter toute pratique sportive. L’examen met en évidence une lésion conjonctive intrinsèque de l’aponévrose du muscle grand glutéal classée stade 2 (fig. 2).
La prise en charge consiste, devant le délai, en un traitement fonctionnel avec consigne de repos sportif court avant reprise progressive de l’activité physique médiée par un kinésithérapeute.
Références
1. Mazlout O, Mazlout O, Ladeb MF, et al. Imagerie des traumatismes musculaires aigus des membres inférieurs chez le sportif. Med Hyg 2003;61(2444): 1412-7.
2. Brasseur JL, Zeitoun-Eiss D, Bach G. Valeur pronostique de l’échographie dans les lésions musculaires posttraumatiques. In: Actualités en échographie de l’appareil locomoteur (tome VIII). 2011.
3. Schwitzguebel AJ, Muff G, Naets E, et al. Prise en charge des lésions musculaires aiguës en 2018. Rev Med Suisse 2018;14(613):1332-9.
4. Rodineau J, Durey A. Le traitement médical des lésions musculaires. JAMA Edition Fr (Actualités thérapeutiques) 1990:20-2.
5. Carrillon Y, Cohen M. Imaging findings of muscle traumas in sports medicine. J Radiol 2007;88(1 Pt 2):129‑42.
2. Brasseur JL, Zeitoun-Eiss D, Bach G. Valeur pronostique de l’échographie dans les lésions musculaires posttraumatiques. In: Actualités en échographie de l’appareil locomoteur (tome VIII). 2011.
3. Schwitzguebel AJ, Muff G, Naets E, et al. Prise en charge des lésions musculaires aiguës en 2018. Rev Med Suisse 2018;14(613):1332-9.
4. Rodineau J, Durey A. Le traitement médical des lésions musculaires. JAMA Edition Fr (Actualités thérapeutiques) 1990:20-2.
5. Carrillon Y, Cohen M. Imaging findings of muscle traumas in sports medicine. J Radiol 2007;88(1 Pt 2):129‑42.
0
Insuffisance rénale chronique
- En savoir plus sur Insuffisance rénale chronique
- Se connecter ou s'inscrire pour poster un commentaire
Actualités en matière d’addictions
- En savoir plus sur Actualités en matière d’addictions
- Se connecter ou s'inscrire pour poster un commentaire
Antibiothérapie en aérosols
- En savoir plus sur Antibiothérapie en aérosols
- Se connecter ou s'inscrire pour poster un commentaire
Échographie : indications rhumatologiques en cabinet de ville
- En savoir plus sur Échographie : indications rhumatologiques en cabinet de ville
- Se connecter ou s'inscrire pour poster un commentaire