Monsieur G., âgé de 37 ans, consulte aux urgences pour dyspnée et prise de poids. Il décrit l’apparition progressive sur plusieurs semaines d’un gonflement de ses jambes, puis de son ventre et du visage, suivie de l’apparition d’une dyspnée au moindre effort depuis quelques jours. Il n’a pas d’antécédent particulier en dehors d’une allergie à la pénicilline pour laquelle il a fait un œdème de Quincke dans l’enfance et d’une crise de colique néphrétique il y a deux ans.
Paramètres vitaux : fréquence cardiaque (FC) à 89 bpm ; saturation pulsée en oxygène (SpO2) à 94 % en air ambiant ; température (T°) = 36,4 °C ; pression artérielle (PA) à 111/76 mmHg ; fréquence respiratoire (FR) à 19 cycles par minute.
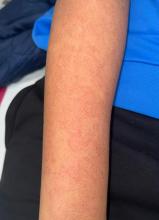
À l’examen clinique, vous mettez en évidence des œdèmes des lombes et des membres inférieurs prenant le godet. Il existe un abdomen tendu avec une matité à la percussion sans organe palpé. À l’auscultation pulmonaire, murmure vésiculaire aboli aux bases de manière symétrique sans bruit surajouté. À l’auscultation cardiaque, bruits du cœur réguliers sans souffle perçu, mais présence d’un frottement péricardique. Pas de turgescence jugulaire (TJ) ni de reflux hépato-jugulaire (RHJ). Le poids est de 105 kg contre 78 kg il y a six mois.
Paramètres vitaux : fréquence cardiaque (FC) à 89 bpm ; saturation pulsée en oxygène (SpO2) à 94 % en air ambiant ; température (T°) = 36,4 °C ; pression artérielle (PA) à 111/76 mmHg ; fréquence respiratoire (FR) à 19 cycles par minute.
À l’examen clinique, vous mettez en évidence des œdèmes des lombes et des membres inférieurs prenant le godet. Il existe un abdomen tendu avec une matité à la percussion sans organe palpé. À l’auscultation pulmonaire, murmure vésiculaire aboli aux bases de manière symétrique sans bruit surajouté. À l’auscultation cardiaque, bruits du cœur réguliers sans souffle perçu, mais présence d’un frottement péricardique. Pas de turgescence jugulaire (TJ) ni de reflux hépato-jugulaire (RHJ). Le poids est de 105 kg contre 78 kg il y a six mois.
Question 1 - Devant ce tableau clinique, vous vous orientez (une ou plusieurs réponses exactes) :
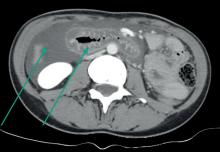
On observe des œdèmes généralisés avec épanchement des séreuses (ascite, épanchement pleural et péricardique).
Un tableau d’anasarque doit faire éliminer une cirrhose décompensée (insuffisance hépatocellulaire avec hypertension portale) mais ici le frottement péricardique et l’œdème du visage ne sont pas en faveur de cette hypothèse en priorité.
Il s’agit d’un tableau d’anasarque avec vraisemblablement la présence d’un épanchement généralisé des séreuses et œdème des membres inférieurs (OMI). L’œdème du visage (souvent présent en décubitus donc au réveil) est en faveur d’un syndrome néphrotique.
Un tableau d’anasarque doit faire éliminer une insuffisance cardiaque globale mais ici l’absence de TJ/RHJ et l’œdème du visage ne sont pas en faveur de cette hypothèse en priorité.
Pas d’ascite, d’OMI, ou d’épanchement des séreuses (sauf si néoplasie invasive) dans un syndrome cave supérieur.