Vous recevez en première consultation de suivi Mme L., patiente primigeste âgée de 22 ans originaire des Antilles, au terme de neuf semaines d’aménorrhée (SA). Elle ne rapporte pas d’antécédent médico-chirurgical notable. L’examen clinique est sans particularité. Elle est adressée par son médecin traitant et vous rapporte les résultats suivants : hémoglobine (Hb) = 7,8 g/dL ; volume globulaire moyen (VGM) = 78 fL ; électrophorèse de l’hémoglobine : HbS = 95 %, HbA absente, HbF = 5 %.
Question 1 - Quel est votre diagnostic ? Comment orientez-vous votre interrogatoire ? Et quels autres examens complémentaires demandez-vous dans ce contexte ? (plusieurs réponses exactes)
Il s’agit d’une drépanocytose homozygote.
La drépanocytose est une maladie à transmission autosomique récessive. Il est donc important de proposer un dépistage du conjoint (électrophorèse de l’hémoglobine) pour évaluer le risque que le fœtus soit atteint par la maladie.
Systématique pour toute femme enceinte en consultation pré-conceptionnelle ou à défaut lors de la première consultation de suivi.
Spécifique aux femmes enceintes atteintes de drépanocytose.




• Avant la conception (ou début de grossesse) :
– conseil génétique : dépistage du conjoint, le Collège national des gynécologues et obstétriciens (CNGOF) recommande une consultation entre 11 et 17 semaines d’aménorrhée (SA) avec dépistage par analyse de l’ADN libre circulant (DPNI) ou interruption en cas d’homozygotie SS ou Sβ0 ;
– clinique : recueil et analyse des antécédents cardiaques, rénaux, ophtalmologiques, évaluation psychosociale ;
– bilan biologique : groupe sanguin étendu, recherche d’agglutinines irrégulières, taux d’hémoglobine de base, bilan hépatique/ionogramme sanguin complet, sérologies VIH, cytomégalovirus (CMV), virus de l’hépatite B (VHB), virus de l’hépatite C (VHC), virus T-lymphotropique de type 1 (HTLV1) et 2, toxoplasmose, rubéole, syphilis, parvovirus B19, examen cytobactériologique des urines (ECBU), prélèvement vaginal ;
– recherche de résultats récents de consultation ophtalmologique, échographie cardiaque, épreuves fonctionnelles respiratoires ;
– vaccination : Pneumo 23 et hépatite B si besoin.
• Surveillance de la grossesse :
– consultations rapprochées : alternance entre gynécologue et médecin référent drépanocytose, toutes les deux à quatre semaines, hebdomadaires dès 36 SA ;
– examens systématiques :
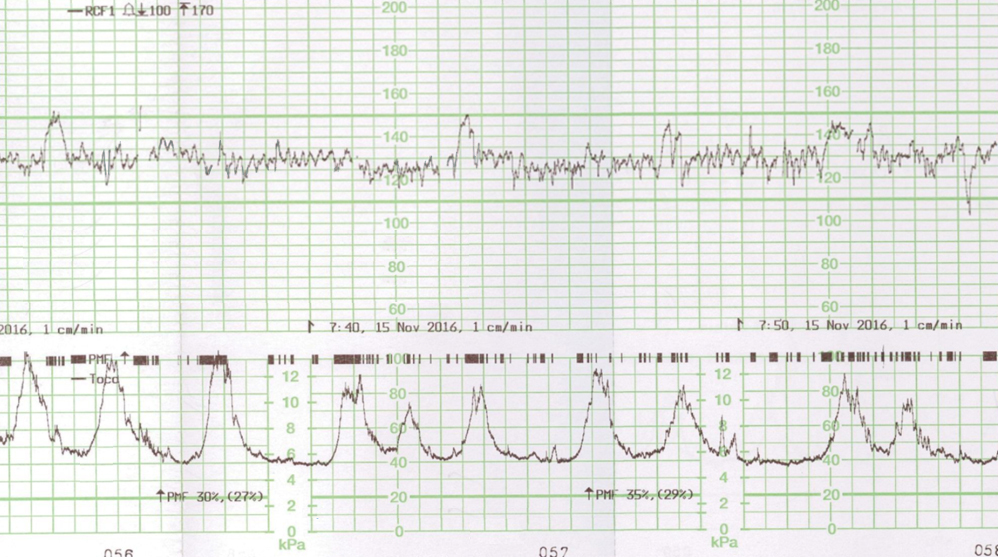
. clinique : dépistage des crises douloureuses et surveillance de la grossesse,
. biologique : numération formule sanguine (NFS), lactate déshydrogénase (LDH), réticulocytes, créatinémie, uricémie, transaminases, protéinurie mensuelle,
. bactériologique : ECBU tous les quinze jours, prélèvement vaginal trimestriel,
. échographie cardiaque au T3,
. EFR si anomalie initiale,
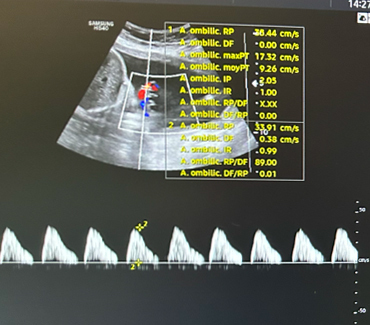
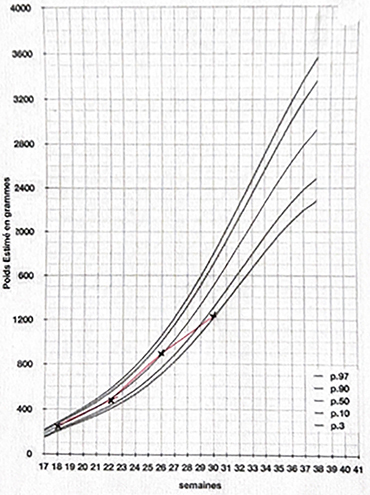
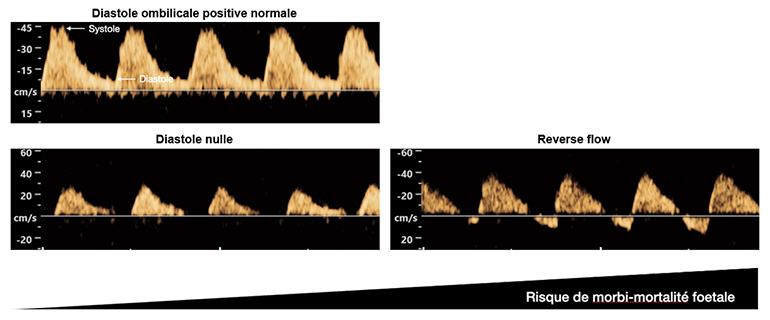
. échographies fœtales rapprochées.
• Prévention des complications :
– règles hygiéno-diététiques : hydratation 2-3 L/j, éviter froid/hypoxie/tabac/alcool ;
– traitement systématique :
. acide folique 10 mg/j,
. vitamine D 100 000 UI en une fois,
. fer si carence documentée,
. kinésithérapie respiratoire (par exemple RespiFlow) ;
– programme transfusionnel, élément clé de la prévention et du traitement des complications.
• Médicaments contre-indiqués :
– corticoïdes : facteur déclenchant de crise vaso-occlusive (CVO), à utiliser avec prudence si indispensable (échange transfusionnel préalable à discuter). Attention donc à la corticothérapie de maturation fœtale ;
– anti-inflammatoires non stéroïdiens (AINS), inhibiteurs de l’enzyme de conversion (IEC), sartans, diurétiques, ribavirine, certains antidiabétiques.
• Traitement des complications :
– deux principales : syndrome thoracique aigu et CVO ;
– conjointement avec les équipes d’anesthésie-réanimation ;
– classique selon les CVO ou syndrome thoracique. Informer le pédiatre.
• Accouchement :
– réchauffement, oxygénation, hydratation, anesthésie loco-régionale si possible. Anesthésie péridurale recommandée ;
– antibioprophylaxie adaptée ;
– discussion sur le choix de la voie d’accouchement selon l’examen clinique.
• Post-partum :
– surveillance stricte de quarante-huit heures en unité de surveillance continue ;
– anticoagulation préventive de sept jours ;
– bonne hydratation (3 à 4 litres par jour dont 1 litre d’eau de Vichy) ;
– toutes méthodes contraceptives possibles. Progestatifs recommandés.