M. O., âgé de 70 ans, consulte en juin 2025 aux urgences pour une dyspnée fébrile. Il a pour antécédent une prothèse de genou gauche sur gonarthrose, une hypothyroïdie supplémentée. Il n’est pas tabagique et ne consomme pas d’alcool. Il a eu, par ailleurs, deux épisodes de pneumopathie lobaire droite. Le premier a eu lieu il y a six mois où il a été hospitalisé et traité par amoxicilline devant une antigénurie pneumocoque positive. Le deuxième épisode a eu lieu il y a trois semaines et a été traité pendant sept jours par lévofloxacine par son médecin traitant avec résolution complète de la symptomatologie après soixante-douze heures d’antibiothérapie. Enfin, depuis deux semaines, il a des douleurs de l’épaule gauche pour lesquelles il a été mis sous kétoprofène depuis quatre jours pour le traitement d’une tendinite.
Depuis quarante-huit heures, il a une dyspnée d’apparition progressive, actuellement au moindre effort, ainsi qu’une fièvre et une pointe basithoracique gauche.
Paramètres vitaux : fréquence cardiaque (FC) = 106 bpm ; saturation en oxygène (SpO2) = 95 % en air ambiant ; température (T°) = 38,9 °C ; pression artérielle (PA) = 146/98 mmHg ; fréquence respiratoire (FR) = 28 cycles par minute.
À l’examen clinique, vous mettez en évidence des crépitants à la base de l’hémichamp pulmonaire gauche ainsi qu’une épaule gauche très douloureuse à la palpation. On ne note pas de confusion, pas de cyanose, ni de tirage respiratoire. Le patient ne tousse pas et n’a pas d’expectorations. Le reste de l’examen clinique est sans particularité. Il vous rapporte toutefois une perte de poids de 5 kg en trois mois.
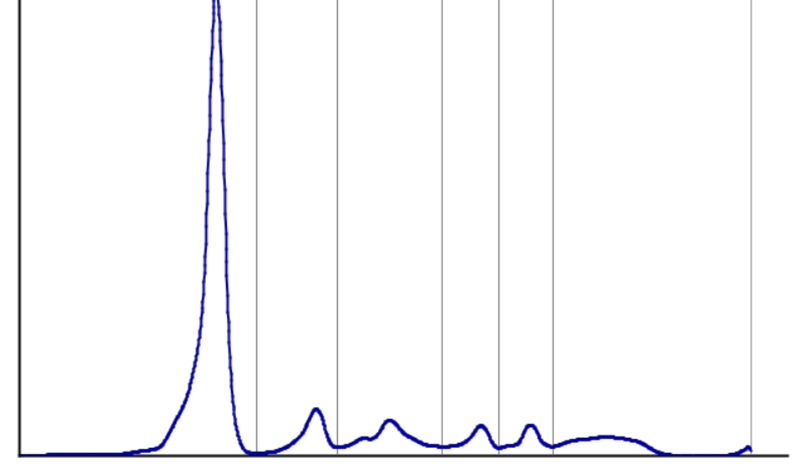
Vous demandez une radiographie thoracique qui met en évidence une opacité lobaire inférieure gauche respectant la scissure interlobaire.
Depuis quarante-huit heures, il a une dyspnée d’apparition progressive, actuellement au moindre effort, ainsi qu’une fièvre et une pointe basithoracique gauche.
Paramètres vitaux : fréquence cardiaque (FC) = 106 bpm ; saturation en oxygène (SpO2) = 95 % en air ambiant ; température (T°) = 38,9 °C ; pression artérielle (PA) = 146/98 mmHg ; fréquence respiratoire (FR) = 28 cycles par minute.
À l’examen clinique, vous mettez en évidence des crépitants à la base de l’hémichamp pulmonaire gauche ainsi qu’une épaule gauche très douloureuse à la palpation. On ne note pas de confusion, pas de cyanose, ni de tirage respiratoire. Le patient ne tousse pas et n’a pas d’expectorations. Le reste de l’examen clinique est sans particularité. Il vous rapporte toutefois une perte de poids de 5 kg en trois mois.
Vous demandez une radiographie thoracique qui met en évidence une opacité lobaire inférieure gauche respectant la scissure interlobaire.
Question 1 - Quelle(s) proposition(s) est/sont exacte(s) ?
L’association d’une dyspnée fébrile, d’une douleur thoracique ainsi que de crépitants à l’auscultation doit faire évoquer le diagnostic de pneumopathie infectieuse. L’existence d’un foyer localisé en base gauche à la radiographie thoracique confirme le diagnostic de pneumonie franche lobaire aiguë.
Le score rapide d’orientation des patients atteints de pneumopathie communautaire est le CRB-65 (confusion, fréquence respiratoire > 30, pression artérielle systolique < 90 mmHg ou diastolique < 60 mmHg, âge > 65 ans). Lorsque le score est ≥ 1, il existe une indication à une hospitalisation. Bien qu’il n’y ait pas de signe de gravité, ce patient étant âgé de 70 ans, il est licite de proposer une hospitalisation d’autant qu’il s’agit du deuxième épisode en moins d’un mois.
En cas de pneumonie aiguë communautaire non grave chez les sujets âgés ou ayant des comorbidités hospitalisés, en l’absence de documentation (ou peu d’arguments forts pour le pneumocoque), on peut proposer une antibiothérapie probabiliste par amoxicilline/acide clavulanique ou céphalosporine de troisième génération par voie intraveineuse (C3G IV) [céfotaxime ou ceftriaxone] ou par fluoroquinolone antipneumococcique. Ces dernières ne doivent pas être prescrites si le patient a reçu une fluoroquinolone dans les trois derniers mois, ce qui est le cas chez notre patient. La lévofloxacine est par ailleurs réservée au traitement des pneumonies aiguës communautaires si aucun autre antibiotique ne peut être utilisé.
L’ECBC n’est réalisable que chez les patients ayant une toux avec expectoration spontanée. En cas de nécessité de documentation, on peut parfois demander une expectoration induite (après aérosol de sérum physiologique hypertonique) nécessitant un personnel formé ou bien des méthodes invasives tels que le lavage broncho-alvéolaire.
Hors des périodes d’épidémies grippales (novembre et avril), il n’est pas nécessaire d’adjoindre un traitement antigrippal. Ici, le patient consulte en juin.